关注生命科学领域突破进展,聚焦热点政策,观澜创新治疗产品行业动态,耕耘于分秒,收获于细微,做乘风破浪的生物医药人!

01
全球首批!首款治疗脑瘤的溶瘤病毒在日本获批
日前,第一三共(Daiichi Sankyo)公司宣布,溶瘤病毒疗法Delytact(teserpaturev/G47∆)已经获得日本厚生劳动省(MHLW)的条件性限时批准(conditional and time-limited approval),用于治疗恶性胶质瘤。新闻稿指出,这是世界上首款获得批准治疗原发性脑瘤的溶瘤病毒疗法。
02
美国FDA今日批准“人造皮肤”,治疗烧伤患者
6月15日,美国FDA宣布,批准Mallinckrodt公司旗下Stratatech开发的StrataGraft上市,用于治疗成人深度部分厚度烧伤患者。这些患者的烧伤部位仍然保留部分深度皮肤组织,需要接受皮肤移植手术治疗。
03
西比曼双靶点CAR-T产品获得FDA孤儿药资格认定
在2021年美国临床肿瘤学会(ASCO)年会上西比曼公布了新型CD19/CD20双靶点CAR-T细胞产品C-CAR039对于治疗滤泡性淋巴瘤方面的最新临床数据后,获得了广泛关注。近日,西比曼生物再获捷报,针对滤泡性淋巴瘤的治疗,FDA授予了C-CAR039孤儿药资格认定。
04
新型CD38单抗的1期临床试验完成首例患者给药
近日,专注于创新疗法和医药产品的开发和商业化的CASI Pharmaceuticals, Inc.宣布,其研究性新型抗CD38单克隆抗体CID-103的1期剂量递增和扩展研究,已完成首例患者的入组和给药,用于既往接受过治疗的复发或难治性多发性骨髓瘤患者。该1期研究旨在评估CID-103的安全性、耐受性、药理学和临床活性。
05
复星凯特FKC876新增适应症获批临床
复星凯特生物科技有限公司今日宣布,国家药品监督管理局(NMPA)已正式批准公司CD19靶点自体CAR-T细胞治疗产品阿基仑赛注射液(FKC876)的新增适应症注册临床试验申请(IND)【受理号CXSL2100098】,用于治疗二线或以上系统性治疗后复发或难治性惰性非霍奇金淋巴瘤(r/r iNHL)。
06
Avenue非阿片类止痛药tramadol新药申请再次遭FDA拒绝
日前,美国FDA发布的一份完整回应函的详细信息显示,FDA再次拒绝批准Avenue Therapeutics静脉注射、非阿片类止痛药tramadol。在新的CRL中,FDA表示当单独给予tramadol治疗急性疼痛时,静脉治疗的不可预测性以及延迟的镇痛作用,不足以证明该疗法的收益。此外,FDA在CRL中表示,迄今为止没有足够的数据支持静脉注射tramadol与其他镇痛药物在预期批准人群中的安全性和有效性。此次CRL中没有概述tramadol相关的化学、制造和控制问题。
07
奥科达/Oakrum宣布JADENU(R) Sprinkle仿制药上市
6月14日,奥科达制药携手Oakrum制药正式宣布JADENU(R) Sprinkle的仿制药成功上市,其中包括90mg, 180mg, 和 360mg三个规格。
08
亚盛医药Bcl-2抑制剂APG-2575获美国FDA临床试验许可
6月15日,亚盛医药宣布,公司在研原创新药Bcl-2抑制剂APG-2575的临床试验申请获美国食品药品监督管理局(FDA)临床试验许可,将展开单药或与抗癌药物联合治疗晚期ER+乳腺癌或实体瘤的研究。
09
「阿立哌唑口服溶液」拟纳入优先审评
6月15日,中国国家药监局药品审评中心(CDE)最新公示,大冢制药(Otsuka Pharmaceutical)旗下四川大冢制药有限公司的阿立哌唑口服溶液,以符合儿童生理特征的儿童用药品新品种、剂型和规格,被CDE纳入优先审评,拟定适应症为:6~17岁儿童和青少年的孤独症易激惹症状;6~17岁儿童和青少年的抽动秽语综合征。
10
靶向VEGF和补体!信达生物双特异性融合蛋白获批临床
中国国家药监局药品审评中心(CDE)最新公示显示,信达生物1类新药IBI302获得一项临床试验默示许可,拟开发治疗糖尿病性黄斑水肿(DME)。根据信达生物官方资料,IBI302是该公司自主开发的一款“first-in-class”在研药,是全球首个靶向血管内皮生长因子(VEGF)和补体的双特异性融合蛋白。
11
默沙东Keytruda在华获批第7项适应症,结直肠癌一线治疗!
6月15日,默沙东(MSD)宣布,其重磅PD-1抑制剂帕博利珠单抗(商品名:可瑞达,Keytruda)已获得中国国家药品监督管理局(NMPA)批准,单药用于KRAS、NRAS和BRAF基因均为野生型、不可切除或转移性高微卫星不稳定性(MSI-H)或错配修复基因缺陷型(dMMR)结直肠癌(CRC)患者的一线治疗。根据新闻稿,帕博利珠单抗是目前中国唯一单药获批用于此类MSI-H/dMMR晚期结直肠癌一线治疗的PD-1抑制剂。
12
先声药业引进的CDK 4/6抑制剂获批临床
中国国家药监局药品审评中心(CDE)最新公示显示,先声药业和G1 Therapeutics联合申报的注射用trilaciclib获得一项临床试验默示许可,拟开治疗三阴性乳腺癌。先声药业发布新闻稿称,将启动trilaciclib转移性三阴性乳腺癌中国注册临床研究。公开资料显示,trilaciclib是G1 Therapeutics开发的一款CDK 4/6抑制剂。
13
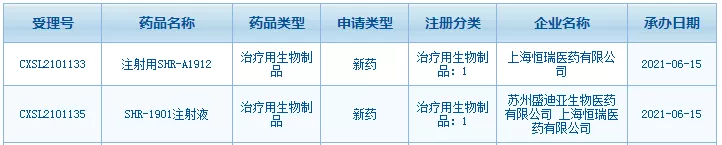
恒瑞医药申报第5款ADC药物:SHR-A1912
6月15日,恒瑞医药2款大分子新药的临床试验申请获得NMPA受理,分别为SHR-1901和SHR-A1912。
14
亚虹医药:APL-1202与替雷利珠单抗联合新辅助治疗MIBC新药临床研究申请获FDA批准
6月15日,亚虹医药宣布APL-1202与替雷利珠单抗联合新辅助治疗肌层浸润性膀胱癌的新药临床研究申请获FDA批准。主要研究目标包括:评估联合用药治疗MIBC患者的安全性、作为MIBC新辅助治疗的2期临床研究推荐剂量以及疗效等。
15
三生国健HER2/PD1双抗在美国获批临床
6月15日,三生国健发布公告,双特异抗体SSGJ-705治疗晚期或转移性HER2表达阳性实体瘤患者的 I 期、多中心、开放标签、首次人体临床试验获得美国食品药品管理局 (FDA)批准。这是三生国健首个申报临床的双抗,该产品目前还未在国内申报临床。
16
金耀药业「甲泼尼龙琥珀酸钠」获得美国ANDA
6月16日,天津天药药业股份有限公司(简称“天药股份”)宣布,其子公司天津金耀药业有限公司(简称“金耀药业”)获得注射用甲泼尼龙琥珀酸钠的新药简略申请(ANDA,即美国仿制药申请)批准文号(意味着可以生产并在美国市场销售该产品)。
17
众生药业FGFR4抑制剂化合物专利获美国专利局授权
6月16日,广东众生药业发布公告,收到美国专利商标局颁发的专利证书,发明名称为FGFR4 INHIBITOR AND PREPARATION METHOD AND USE THEREOF,中文名为:FGFR4抑制剂及其制备方法和应用。专利号:11,008,292,专利到期时间为2037年11月16日。
18
第2家!石药集团抗Claudin 18.2 ADC获批临床
6月16日,石药集团发布公告,本集团开发的抗体药物偶联物(Antibody-Drug Conjugate) SYSA1801已获得国家药品监督管理局批准,可开展于中国的临床研究。该产品在国内外已提交多件专利申请。
19
精准疗法获FDA批准扩展适应症,基石拥有大中华区权益
6月17日,Blueprint Medicines宣布,美国FDA已批准Ayvakit(avapritinib)治疗晚期系统性肥大细胞增多症(advanced SM)成人患者,包括侵袭性SM(ASM)、伴有血液肿瘤的SM(SM-AHN)和肥大细胞白血病(MCL)。新闻稿指出,晚期SM患者现在首次可以接受一种靶向治疗,旨在强效和选择性地抑制疾病的中心驱动因子——携带D816V突变的KIT酪氨酸激酶。
20
编码TNFα和hIL-2的新型溶瘤病毒提交IND申请,推进针对卵巢癌的临床计划
近日,生物技术公司TILT Biotherapeutics宣布,目前提交了免疫疗法TILT-123在卵巢癌1期试验的IND。该试验将评估该公司的腺病毒癌症免疫疗法TILT-123与默沙东的抗PD-1疗法KEYTRUDA(派姆单抗)联合在铂耐药以及难治性卵巢癌患者的安全性和有效性,并旨在获取有关TILT-123在人体作用中的数据。
21
新型联用策略,IL-15超激动剂与NK细胞疗法有望增强TROP-2 ADC的抗肿瘤活性
近日,临床阶段免疫治疗公司ImmunityBio, Inc.宣布,一项联合疗法1b/2期临床研究获得FDA的授权批准。该联合疗法以超激动剂Anktiva(N-803,一种IL-15超激动剂)、PD-L1.t-haNK、标准化疗以及Trodelvy(sacituzumab govitecan-hziy)组合的,该试验主要评估该组合疗法在患有晚期三阴性乳腺癌(TNBC)患者中的安全性和有效性。
22
贝达药业CDK4/6抑制剂获批临床,针对乳腺癌
根据中国国家药监局药品审评中心(CDE)公示信息,贝达药业的BPI-16350胶囊获得两项临床试验默示许可,拟开发治疗乳腺癌。公开资料显示,BPI-16350是一款在研的CDK4/6抑制剂,属于1类新药,此前已在中国获批针对实体瘤的临床研究。
23
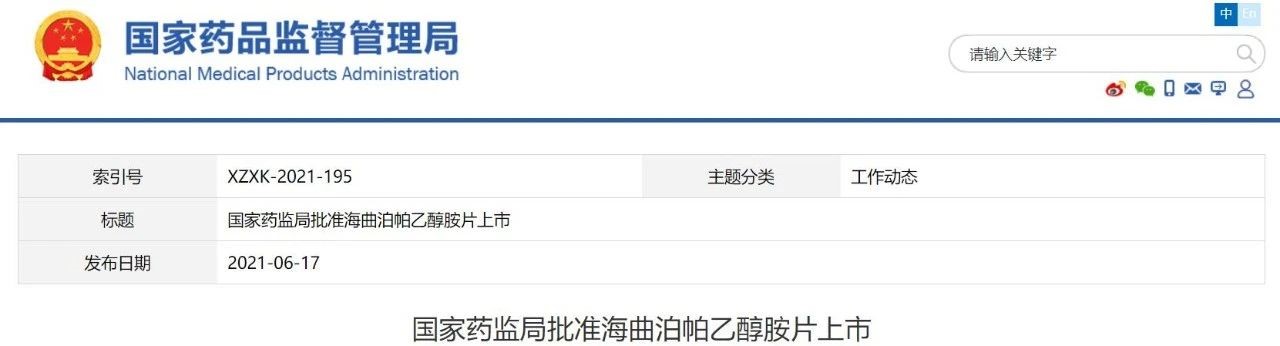
恒瑞医药1类新药「海曲泊帕乙醇胺片」获批上市
6月17日,中国国家药品监督管理局(NMPA)宣布,已通过优先审评审批程序批准恒瑞医药1类创新药海曲泊帕乙醇胺片(商品名:恒曲)上市,用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。其中SAA适应症为附条件批准。
24
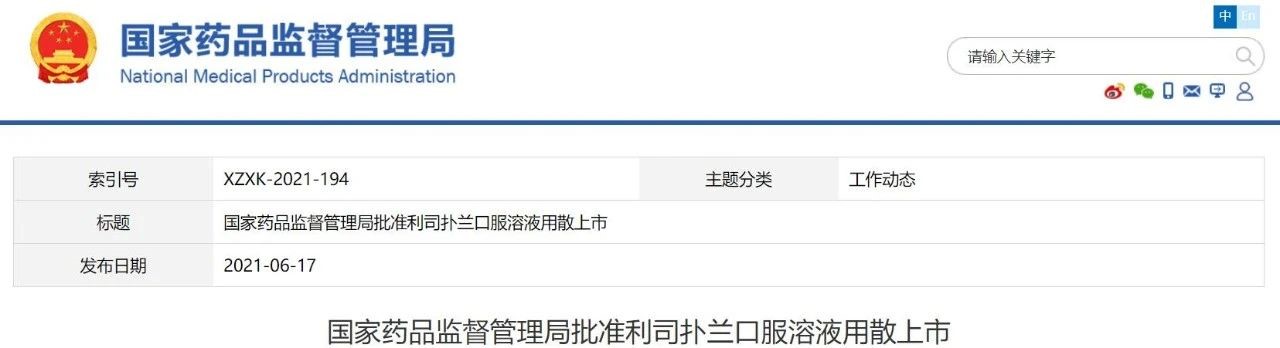
罗氏1类新药口服SMA疗法利司扑兰获批
6月17日,国家药监局通过优先审评审批程序批准罗氏申报的1类创新药利司扑兰口服溶液用散(商品名:艾满欣)上市,该品种为儿童罕见病治疗药品,适应症为2月龄及以上患者的脊髓性肌萎缩症(SMA)。

对1-60岁SMA患者均显示效力,罗氏口服创新疗法最新临床结果积极
6月11日,罗氏(Roche)宣布,口服脊髓性肌萎缩症(SMA)疗法Evrysdi(risdiplam)在两项临床研究中获得积极结果。试验最新数据表明,在之前接受过其它SMA疗法治疗的1至60岁患者中,Evrysdi将SMN蛋白水平提高两倍以上,安全性与之前研究保持一致。此外,症状出现前就开始接受治疗的2个月以下SMA婴儿,在接受Evrysdi治疗至少12个月后达到了与年龄一致的运动里程碑以及运动功能的改善。值得一提的是,risdiplam的监管申请在中国已经被纳入优先审评,有望在今年获得批准。
2
所有患者均获得缓解,CRISPR基因编辑疗法展现“治愈”潜力
6月11日,Vertex Pharmaceuticals和CRISPR Therapeutics联合公布了22例患有输血依赖性β地中海贫血(TDT)或严重镰刀型细胞贫血病(SCD)的患者,接受基于CRISPR/Cas9的基因编辑疗法CTX001治疗的最新临床试验数据。CTX001是一种在研自体CRISPR/Cas9基因编辑疗法。通过在体外对患者的造血干细胞进行改造,使红细胞中产生高水平的胎儿血红蛋白(HbF)。
试验结果显示,所有15例TDT患者在最近一次随访时均不再依赖输血。所有7例SCD患者均无血管闭塞危象(VOCs)。患者的随访时间从4个月到26个月不等。其中5名TDT患者和2名SCD患者的随访时间超过一年,显示出对治疗的稳定和持久反应。这些数据进一步支持CTX001有望成为TDT和SCD的潜在一次性治愈疗法。
潜在“first-in-class”补体抑制剂达到3期临床终点,今年递交监管申请
日前,赛诺菲(Sanofi)公司宣布,其潜在“first-in-class”补体C1s蛋白抑制剂sutimlimab在治疗冷凝集素病(CAD)患者的关键性3期临床试验中达到主要终点,能够迅速并且持续抑制CAD患者中C1激活导致的溶血,它同时为患者的血红蛋白水平和疲惫提供具有临床意义的改善。赛诺菲计划在今年下半年向美国FDA递交生物制品许可申请(BLA)。新闻稿指出,如果获得批准,它有望成为首款获批治疗CAD患者溶血的疗法。
完全缓解率达100%,创新CAR-T疗法初步临床结果积极
日前,Autolus Therapeutics公司宣布,其在研CAR-T疗法obecabtagene autoleucel(obe-cel,又名AUTO1),在治疗惰性B细胞非霍奇金淋巴瘤(iNHL)的一个患者队列中达到100%的完全缓解率,同时并没有在患者中发现高级别的细胞因子释放综合征和免疫效应细胞相关神经毒性综合征(ICANS)。
翰思生物启动CD47/PD-1双特异性抗体2期临床
近日,翰思生物宣布,已启动抗CD47/PD-1双特异性抗体HX009注射液的2期临床研究,拟开发治疗晚期实体瘤。值得一提的是,在最近举行的美国临床肿瘤学会(ASCO)大会上,翰思生物也公布了HX009的最新临床数据。
难治性患者完全缓解率超过30%,CD37靶向ADC组合2期临床结果积极
6月14日,Debiopharm宣布其CD37靶向抗体偶联药物(ADC)naratuximab emtansine,与利妥昔单抗(抗CD20抗体)联用,在治疗复发/难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)的2期临床试验中获得积极结果。试验结果显示,组合疗法在曾经接受过2种以上前期治疗的R/R DLBCL患者中,达到31.6%的完全缓解率(CRR)。
90.4%总体保护力,重组蛋白新冠候选疫苗3期临床结果积极
6月14日,Novavax公司宣布,其基于重组蛋白的纳米颗粒新冠候选疫苗NVX-CoV2373在关键性3期临床试验中达到主要终点,总体保护效力为90.4%。此外,它对中度和重度COVID-19的防护效力为100%,在高风险人群中有效性为91%。而且,NVX-CoV2373对主要关注突变株(VoC)/待观察突变株(VoI)也表现出良好的保护效力。
强生Imbruvica联合罗氏Venclexta治疗CLL/SLL三期临床试验成功
6月14日,据外媒报道,强生的Imbruvica联合罗氏旗下Genentech的Venclexta (venetoclax)在一项III期GLOW研究中取得了成功,此研究评估了该联合疗法作为老年或健康状况欠佳的慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的一线治疗。
特应性皮炎新药CCR4抑制剂Ib期结果积极,公司股价翻倍
6月16日,再生元(Regeneron)公司
6月14日,RAPT Therapeutics宣布,RPT193单药治疗31例中重度特应性皮炎患者的随机、安慰剂对照Ib期临床试验获得积极顶线结果。受此消息影响公司股价翻倍,市值达到9亿美元。
治疗阿尔茨海默病,创新tau蛋白疫苗2期临床结果发表
6月15日,Axon Neuroscience公司宣布,其用于治疗阿尔茨海默病(AD)的tau蛋白疫苗AADvac1的2期临床试验完整结果在《自然》子刊Nature Aging发表。试验结果表明,AADvac1具有优秀的安全性,并且激发强劲的抗体反应,对神经变性产生显著影响。
在通过疾病生物标志物确认的AD患者中,AADvac1表现出疗效信号,显著延缓患者临床指标和功能指标的下降速度。
潜在“first-in-class”口服抗抑郁药达到3期临床终点
6月15日,Sage Therapeutics和渤健 (Biogen)联合宣布,针对重度抑郁症(MDD)患者的潜在“first-in-class” 口服药物zuranolone (SAGE-217/BIIB125)在3期临床试验中达到了主要终点。这是一种新一代γ-氨基丁酸(GABAA)受体别构调节剂。在第15天时,通过17项汉密尔顿抑郁量表(HAMD-17)评估,与安慰剂相比,zuranolone使患者抑郁症状获得统计显著且具有临床意义的减轻(p=0.0141)。试验过程中观察到zuranolone快速起效,并表现出与既往临床研究一致的安全性特征。
ASCO 2021速递丨基石药业合作产品艾伏尼布公布多种晚期肿瘤最新临床数据
在刚刚举行的2021年美国临床肿瘤学会(ASCO)虚拟年会上,艾伏尼布(Ivosidenib),作为全球首款获得美国FDA批准针对IDH1突变的复发性或难治性急性髓系白血病(R/R AML)疗法,其多项研究进展亮相ASCO,包括艾伏尼布在既往治疗IDH1突变胆管癌、成人复发或难治性急性髓系白血病以及切除的 m IDH1低级别胶质瘤的临床进展。
IDH1是三羧酸循环中的一种限速酶,其基因突变发生可见在于包括急性髓性白血病(AML)、胆管癌和神经胶质瘤在内的多种肿瘤。相关数据说明,艾伏尼布(Ivosidenib)在多种晚期肿瘤治疗中有巨大的应用价值。
默沙东CTLA-4单抗进入3期临床,2亿美元从康方生物引进
6月16日,康方生物发布新闻稿称,公司以2亿美元授权给默沙东(MSD)的CTLA-4单抗quavonlimab(MK-1308),已经进入3期临床研究阶段。目前,一项针对晚期肾透明细胞癌(ccRCC)一线治疗的3期临床研究已经启动,旨在探索MK-1308A(MK-1308 + Keytruda)联合Lenvima,对比Keytruda联合Lenvima的疗效和安全性。
降低特定住院患者死亡率20%,新冠中和抗体组合3期临床结果积极
6月16日,再生元(Regeneron)公司宣布,其在研中和抗体疗法REGEN-COV(casirivimab和imdevimab)在3期临床试验RECOVERY中获得积极初步结果。试验结果表明,在本身没有对新冠病毒产生天然抗体应答的COVID-19住院患者中,相比对照组,在常规护理的基础上加用REGEN-COV能够使患者死亡风险降低20%。新闻稿指出,RECOVERY是首个证明中和抗体可以降低COVID-19住院患者死亡率的大型临床试验。再生元将立刻与监管机构讨论最新研究结果,并且要求美国FDA扩大紧急使用授权(EUA)以纳入适当的住院患者。
渤健AD治疗药物gosuranemab 2期临床失败
据外媒报道,渤健6月16日宣布了Gosuranemab (BIIB092)的2期TANGO研究结果。Gosuranemab是一种实验性抗tau抗体,目前正被评估为治疗阿尔茨海默病的潜在药物。在因阿尔茨海默病和轻度阿尔茨海默病导致的轻度认知障碍 (MCI) 患者中,与安慰剂相比,Gosuranemab在第78周的临床痴呆评定量表-框总和(CDR-SB)中未达到其主要疗效终点痴呆。

01
Nat Methods | 熊伟/仓春蕾等揭示细胞衰老过程的溶酶体代谢组学异质性改变

2021年6月14日,中国科学技术大学附属第一医院脑衰老与脑疾病研究中心、中科大生命科学与医学部的熊伟教授课题组与仓春蕾教授课题组合作,在Nature Methods上发表了题为Metabolomic Profiling of Single Enlarged Lysosomes的研究论文。该研究建立了世界上首个单溶酶体代谢组质谱检测技术(SLMS),首次实现了基于单个溶酶体代谢组学信息的溶酶体分型,并深度探索了细胞衰老过程中溶酶体代谢组学的异质性改变。
更多解读:
人们普遍认为,衰老过程中溶酶体的功能受损,溶酶体功能障碍可能导致溶酶体合成分解等代谢能力的降低。那么是所有类型的溶酶体的代谢能力都受损?还是只是某些类型的溶酶体代谢功能受损呢?而其它类型溶酶体又是如何改变的呢?熊伟教授与仓春蕾教授团队通过上述SLMS技术对该问题进行了研究。首先,基于单溶酶体代谢组,他们对各不同细胞来源(肾细胞、成纤维细胞、上皮细胞等)的溶酶体进行了分类,发现在各类细胞中溶酶体均被分为了5个亚群,且均包含了内吞溶酶体和自噬溶酶体。接下来作者基于单溶酶体代谢组学分析研究了细胞衰老过程中各类溶酶体的代谢组的变化。发现自噬溶酶体中大多数代谢物显著下调,而内吞溶酶体则相反。在数量上,细胞中自噬溶酶体的比例显著降低,从22%下降到10%,而内吞溶酶体的比例从15%上升到了23%,其它类型溶酶体的比例变化则不明显。此外,作者也对5个溶酶体亚群在细胞衰老过程中的代谢变化分别展开了解析,发现每类溶酶体亚群的代谢组学改变均不相同。这就说明细胞衰老过程中溶酶体的代谢变化是存在溶酶体类型特异性的,因此研究衰老过程中各类溶酶体的变化异质性是针对性解决细胞衰老及其相关疾病的重要路径之一。
值得一提的是,熊伟教授课题组前期通过学科交叉合作共同建立了单细胞质谱技术以及质谱成像技术,用于检测单个细胞内以及整体器官的代谢组(PNAS, 2017; Cell, 2018; Anal Chem, 2019a,b; Cell Reports, 2020; Nature Communications, 2021)。此次单溶酶体质谱技术的开发,使得该团队可以从细胞器到细胞乃至器官整体进行代谢组学的全面研究,为多尺度多维度解析衰老过程中的代谢组学变化及代谢通路机制打下了良好的基础。
上述相关内容可参考熊伟教授课题组网站(http://x-lab.ustc.edu.cn/)。
据悉,中国科学技术大学生命科学与医学部副教授朱洪影,博士研究生李倩倩、廖铁鹏为论文共同第一作者,熊伟教授、仓春蕾教授为论文共同通讯作者。中国科学技术大学的黄光明教授、暨南大学的鞠振宇教授参与了合作研究。
原文链接:
https://www.nature.com/articles/s41592-021-01182-8
02
Nature | 肠道微生物特异性T细胞在胸腺中的发育

近日,纪念斯隆凯特琳癌症中心Gretchen Diehl和犹他大学医学院Matthew Bettini团队在Nature上在线发表了题为Thymic development of gut microbiota-specific T cells 的研究论文。发现生命早期的肠道定植使得肠道树突状细胞(DCs)将微生物抗原从肠道转运到胸腺,然后诱导微生物特异性T细胞的扩增。进入外周后,微生物特异性的T细胞即获得了致病潜力或能保护其免受相关病原体感染。通过这种方式,发育中的微生物种群能够塑造并扩大胸腺和外周T细胞多样性,使其加强对肠道微生物和病原体的识别。
分段丝状细菌(Segmented filamentous bacteria, SFB)是一种梭菌相关的共生微生物群,也是为数不多的确定了微生物特异性TCR的共生微生物之一,因此得以有确定的SFB四聚体用以追踪SFB特异性的T细胞。研究人员分别在年轻(刚刚断奶)和成年(12周)的无特定病原体(SPF)小鼠中定植SFB,两周后对T细胞群进行检测,发现年轻小鼠的胸腺中出现了SFB特异性的单阳性CD4+ T细胞,而成年小鼠中则未出现。而胸腺细胞总数、成熟程度以及SFB特异性的其他胸腺细胞亚群未发生变化。随后,研究人员通过流式细胞术以及RNA-seq对这群细胞进行了表征,绝大多数SFB特异性的CD4+ T细胞表现出CD24-TCRβ+CD25-Foxp3-的表型以及不同水平的CD44和CD69表达,表明这群细胞经历了阳性选择;同时还利用静脉注射CD45抗体和检测Rag2和CD73的表达确认了这群细胞是刚刚完成发育的T细胞而非血液中的循环细胞。外周(肠系膜淋巴结(MLNs)和回肠)T细胞的动力学变化在年轻和成年小鼠中则有所不同,此外,研究人员在定植后的年轻小鼠胸腺和MLNs中都发现了SFB的DNA。
接下来,研究人员通过与T细胞数量动态比对、肠道APCs分群、CX3CR1-DTR等模型方法确定了辅助微生物特异性T细胞胸腺扩增的抗原提呈细胞(APCs)— CX3CR1+ DCs,CX3CR1+ DCs的特异性删除显著降低了胸腺SFB特异性的T细胞扩增,并降低了胸腺和MLNs中细菌16S DNA的总水平。为了进一步了解细胞从肠道向胸腺迁移的特点,研究人员使用了KikGR33转基因小鼠,该小鼠所有细胞都表达GFP,在暴露于405nm波长的光后,GFP会光转化为RFP。
对年轻和成年KikGR33小鼠的盲肠进行了光转化,48小时后对远端组织进行分析。在这两组中,胸腺、脾脏和MLNs中均观察到了RFP+细胞,大部分是MHCII+ APCs,这表明盲肠APCs向这些组织的迁移处于稳定状态。有趣的是,在年轻小鼠中,大部分胸腺迁移细胞是CX3CR1+ DCs、脾脏迁移细胞是B细胞,MLNs迁移细胞是CX3CR1- DCs;而在成年小鼠中则分别主要为CX3CR1- DCs和B细胞、B细胞以及B细胞。
最后,研究人员检测了胸腺微生物特异性T细胞是否具有功能,即能否对其外周组织中的抗原作出反应,通过结肠炎T细胞转移模型,定植SFB或大肠杆菌后,分离胸腺中的初始T细胞并转移到SFB或大肠杆菌定植的Rag2-/-小鼠体内。结果显示,与转移未定植的供体相比,转移定植SFB供体的胸腺T细胞后,定植SFB的受体小鼠表现出体重减轻和肠道病理增加,同时免疫浸润增加,TH17细胞的比例更高,SFB特异性结肠T细胞的比例和数量都增加,且大部分表达TH17转录因子RORγt。在转移定植大肠杆菌的供体胸腺T细胞的大肠杆菌定植受体小鼠中也观察到了类似的体重下降、病理和免疫浸润增加,但大肠杆菌定植的受体中更高比例的结肠T细胞表达Th1转录因子T-bet。在CX3CR1-DTR小鼠中重复上述实验,与野生型相比,转移CX3CR1删除的供体胸腺T细胞SFB定植受体小鼠表现出体重减轻、炎症、免疫浸润和SFB特异性T细胞减少等特征。
总的来说,该研究发现在年轻的小鼠中,肠道微生物定植驱动了微生物特异性的胸腺T细胞扩增,该过程依赖于肠道CX3CR1+DCs将微生物抗原从肠道转运到胸腺的过程。本研究为细菌特异性T细胞在生命早期的发展提供了新的视角,也为细菌特异性的免疫疾病(如炎症性肠病)提供了潜在的治疗策略。
原文链接:
https://www.nature.com/articles/s41586-021-03531-1
03
Adv Sci+Blood | 周家喜和王前飞团队同时揭秘成年骨髓巨核细胞的异质性


近日,中国医学科学院血液病医院(中国医学科学院血液学研究所)周家喜团队和中国科学院基因组研究所王前飞团队近日分别在Advanced Science和Blood杂志上在线发表了人和小鼠骨髓巨核细胞的单细胞转录组图谱,拓展了我们对于巨核细胞分子层面的认知。
其中,中国医学科学院血液病医院(中国医学科学院血液学研究所)周家喜教授联合程涛教授和高欣教授课题组在Advanced Science杂志上在线发表题为“Characterization of Cellular Heterogeneity and an Immune Subpopulation of Human Megakaryocytes”的研究论文,揭秘了人类成年骨髓巨核细胞的异质性以及免疫巨核细胞亚群的潜在功能。
该研究首先从正常供者的骨髓样本中分选获得了以16倍体为主的成熟巨核细胞,并利用Smart-Seq2技术绘制了成人骨髓巨核细胞的单细胞转录组图谱。与本课题组前期人类胚胎巨核细胞的研究相似【5】,成年巨核细胞也具有高度异质性,包括血小板生成偏向、细胞周期活跃以及免疫基因富集等多种特性的巨核细胞亚群。其中免疫亚群可用表面标志分子CD148和CD48标记,CD148+CD48+巨核细胞高表达众多免疫受体并分泌多种免疫调节因子,可能作为潜在的免疫监视器,对多种免疫信号发生应答。同时,本研究利用人骨髓造血干祖细胞模型绘制了巨核分化过程的动态图谱,进一步揭示免疫亚群的特性可以追溯到祖细胞阶段,经由特定的分化路径产生,提示调控早期巨核分化有望生成特定的巨核细胞亚群。
同时,中国科学院北京基因组研究所(国家生物信息中心)的王前飞、李玥莹团队在Blood上在线发表题为“Single-Cell Analysis of Ploidy and Transcriptome Reveals Functional and Spatial Divergency in Murine Megakaryopoiesis”的研究论文。通过镜下手工挑选、流式分选和免疫荧光的系列组合技术,团队首次在国际上鉴定分离了2N-32N不同倍体的单个巨核细胞。
通过单细胞转录组结合单个细胞的倍体信息,该研究组在小鼠和人骨髓中均鉴定到相似的4个功能异质性群体及倍体分布特征,包括多倍体化、免疫、微环境和产板亚群。利用三维免疫荧光技术进行小鼠体内原位检测,发现产板亚群与血管接触,而微环境亚群与造血干细胞位置靠近。体内外功能实验验证了不同亚群在功能上的独特性。其中,免疫亚群不仅可以快速应对炎性刺激发生群体扩张,而且具有吞噬、抗原递呈等功能。最后,通过整合骨髓和肺、胚胎和成体的单细胞数据,发现免疫亚群具有跨越不同种属、组织和发育阶段的保守性,但在形态和分子特征上又区别于经典免疫细胞,从而提出巨核免疫亚群是一个全新的造血谱系分支。此项工作核心发现曾在2019年美国血液年会上荣获当年的最佳成果奖(BEST OF ASH)。
由于人成年骨髓巨核细胞稀少、易碎的特性,一直以来难以分离获得结构完整的巨核细胞。针对这一挑战,王前飞、李玥莹团队突破了分离成年骨髓不同倍体巨核细胞的技术瓶颈,发展建立了小鼠和人原代巨核细胞的高效分离技术。借助于该分离方法,两个研究团队首次在单细胞尺度解析了人和小鼠骨髓巨核细胞的异质性及分化规律,为了解巨核细胞的发育提供了新的见解,也为巨核细胞多种功能是由特定亚群执行的这一观点提供了更直接的证据。此外,正常供者巨核细胞的异质性解析为研究多种疾病条件下巨核细胞的亚群组成和功能变化提供了重要参考,也为相关疾病的诊断和治疗提供了新的研究策略。
原文链接:
https://doi.org/10.1002/advs.202100921
https://doi.org/10.1182/blood.2021010697
04
EMBO J | 欧阳波/林家凌等合作揭示促细胞凋亡蛋白Bax在线粒体膜上独特的成孔模式

2021年6月8日,中科院分子细胞科学卓越创新中心欧阳波团队与美国Oklahoma大学健康科学中心林家凌团队和加拿大Sunnybrook研究院David W. Andrews团队在The EMBO Journal上合作发表题为An amphipathic Bax core dimer forms part of the apoptotic pore wall in the mitochondrial membrane的研究论文。该研究揭示了促细胞凋亡蛋白Bax在线粒体膜上独特的成孔模式。
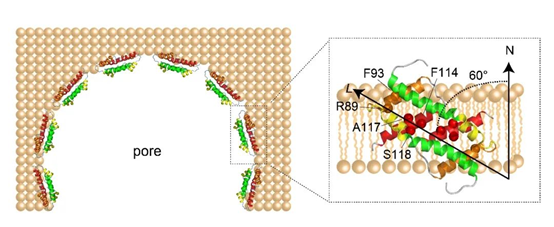
为了研究Bax在线粒体外膜上形成孔洞的机制,欧阳波团队首先将Bax的核心结构域α2-α5放入脂双分子层的类膜体系bicelle中,通过核磁共振技术首次解析了Bax(α2-α5)双体精准的三维在膜结构,发现该结构与已知的溶液中的晶体结构有明显的差异,其中α4和α5形成了一个平整的疏水平面。该团队进一步利用蛋白-磷脂NOE和PRE探针滴定的方法,确定了的Bax(α2-α5)在膜上的精确位置,发现Bax(α2-α5)通过该疏水平面侧贴于膜之边缘,并与膜形成60o的夹角来最大限度的保护疏水磷脂双层。随后通过结构分析,发现R89、F93、F114、A117和S118与膜直接相互作用,因此设计了R89E、F93E、F114E、A117D和S118D的突变,来破坏Bax与膜的静电相互作用或者疏水相互作用,验证该核磁结构的准确性。接下来,林家凌团队通过脂质体荧光色素释放实验发现这些突变体都显著地降低了Bax的破膜活性。David W. Andrews团队利用线粒体膜通透性实验,在细胞中进一步证实了这些突变体在天然线粒体膜中成孔能力下降。以上这些结构和功能实验揭示了Bax核心结构域侧贴在膜的特殊成孔方式,拓宽了人们对蛋白在膜上成孔分子机制的理解和认识。
中国科学院分子细胞科学卓越创新中心的博士生吕福娇和温茂荣博士,美国Oklahoma大学的齐飞硕士和张志研究助理以及加拿大Sunnybrook研究院的Justin Kale博士为本文的共同第一作者。中国科学院分子细胞科学卓越创新中心的欧阳波研究员,美国Oklahoma大学健康科学中心的林家凌教授和加拿大Sunnybrook研究院的David W. Andrews教授为本文的共同通讯作者
中国科学院分子细胞科学卓越创新中心的博士生吕福娇和温茂荣博士,美国Oklahoma大学的齐飞硕士和张志研究助理以及加拿大Sunnybrook研究院的Justin Kale博士为本文的共同第一作者。中国科学院分子细胞科学卓越创新中心的欧阳波研究员,美国Oklahoma大学健康科学中心的林家凌教授和加拿大Sunnybrook研究院的David W. Andrews教授为本文的共同通讯作者。
原文链接:
https://www.embopress.org/doi/full/10.15252/embj.2020106438
05
Cell | 人体内存在类似于2G12抗体的I型天然抗体或可成为HIV-1疫苗新靶点

近日,杜克大学疫苗研究所、杜克大学医学系和免疫学系等单位的Wilton B. Williams、PriyamvadaAcharya和Barton F. Haynes团队在Cell上发表了题为Fab-dimerized glycan-reactive antibodies are astructural category of natural antibodies 的研究论文,该文中作者报道了多个天然Fab二聚化的具有多糖反应性的(Fab-dimerized glycan-reactive,FDG)HIV-1 Env抗体,它们有着类似2G12的I型构象,区别于普通抗体的Y型构象。但是,它们中和HIV-1不需要VH结构域的互换。FDG抗体除了识别酵母和HIV-1 Env多糖,还能识别SARS-CoV-2的刺突蛋白S2亚基。
首先,作者用一个糖基化的多肽(Man9-V3)模拟天然的HIV-1的Env三聚体来免疫恒河猴,随后在其血浆中分离到4个DH717世系的抗体DH717.1、DH717.2、DH717.3和DH717.4。这些抗体能够识别HIV-1的重组Env可溶性三体、白色念珠酵母和新型隐球酵母聚糖,同时亲和力比2G12抗体更强。它们对Man9-V3的识别是基于它的多糖基序而非多肽序列本身。
在负染电镜(NSEM)下,看到其中DH717.1、DH717.2、DH717.4三种抗体亚型具有经典的Y型特殊的I型两种构象。其中的I型构象,类似于2G12抗体的构象,是由于Fab的二聚化而形成的,称为FDG(Fab-dimerized glycan-reactive,FDG)抗体。只是2G12抗体的两个Fab区域相对于Fc是在同一个平面上并列的,而H717 I型抗体的两个Fab片段相对于Fc不在同一平面上,而是偏转了90°夹角。同时,这种FDG抗体不存在类似于2G12的VH结构域互换现象。随后,通过晶体结构的解析验证了这一结果。并解释了Fab的二聚化的出现由几种机制介导,包括Fab-Fab之间形成的二硫键,疏水相互作用和氢键。其中主要是C74位置相对于普通抗体额外形成的二硫键主导了Fab的二聚化和I型构象的形成。
随后,作者通过转录组测序,对恒河猴血液中B细胞进行分群和溯源,发现产生这种结合多糖的I型抗体的B细胞在免疫前就存在,至少在受到刺激后才进一步成熟和扩增。这种现象在人体内也得到验证。从HIV-1血清反应阴性的人体内分离到了前体FDG 抗体,它们存在于IgM+IgD+CD27+的边缘区B细胞中。说明这种抗体在人体内也天然存在。这一研究结果可能为HIV-1的疫苗研究提供新的靶点。
作者在文中只检测了这种FDG抗体对重组HIV-1 Env和SARS-CoV-2 S蛋白多糖反应活性,但是这可能排除了体内其它类型的多糖形式。文章中检测了9位未感染HIV-1的个体外周血中的前体FDG抗体,未来需要在一个更大的群体的个人和其他免疫组织将对这些Abs的信息进行更深入研究。
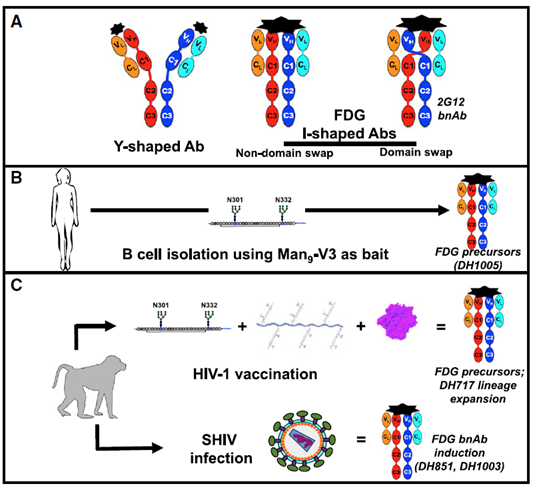
多种病原体,包括HIV的包膜蛋白【1】、酵母【2】(Hall and Gow, 2013)、SARS-CoV-2的纤突蛋白 (Watanabe et al., 2020) 表面都具有糖基化修饰。机体内识别糖基化的抗体为一系列天然抗体,在机体受到同类型抗原刺激之前就已经存在。它们存在不同的亚型,并且为机体提供抵抗外界细菌、真菌和病毒感染的第一道防线【3】(Holodick et al., 2017)。在人体内,天然抗体在受到抗原刺激后产生突变抗体或一些未知变化例如IgM抗体在免疫前B细胞中的抗体变化方式【3】,目前将其假定为来自边缘区或过渡期的B细胞【4】。
艾滋病病毒1型(HIV-1)的包膜蛋白(Env)具有严重糖基化现象,抗体对广泛性中和抗体(bnAb)识别的位点抗原表位的识别受到限制【1】(Cao et al., 2017)。HIV-1 Env的bnAb能够通过长的互补决定区(CDR)环接近Env蛋白表位,但同时也和其周围的多糖达成了某种平衡,而影响其中和效应【5】。因此,研究人员一直在寻找特异地抗多糖的抗体,试图将HIV-1的这一有效防御手段变成它的弱点【6】。然而,存在于HIV-1和其它病原体上的多糖也存在于宿主分子上【7】,因此,病原体多糖诱导产生的抗体可能会被机体的免疫耐受抑制。此前的研究中,2G12抗体是唯一的一个只特异结合HIV-1 Env蛋白多糖的例子【8】。2G12抗体有一个相对较短的CDR3环和一个独特重链可变区(VH)结构域互换(图1)。其中,两个抗体结合片段(Fab)的互换形成一个Fab的二聚化多价体表面,具有极强的Env表面多糖结合能力【9】。2G12抗体的Fab二聚化,已被证明在结合HIV-1上起着至关重要的功能,这使它从普通的结合能力较弱的多糖结合抗体中脱颖而出。
bnAb 2G12与HIV-1的亲和力大约在nM级别,主要是由于它能够多价识别一个独特的多糖集群【10】。x射线晶体学、负染电镜和冷冻电镜(cryo-EM)的结果共同展示了2G12抗体VH结构域互换和Fab的二聚化,以及它的多重多糖结合位点【11】。这两个特点对其高亲和性结合HIV-1的Env至关重要。除了HIV-1 Env,2G12还能结合白色念珠酵母,由于它和HIV-1 Env多糖具有相似的甘露糖基序【12】。
原文链接:
https://doi.org/10.1016/j.cell.2021.04.042
06
Nature Aging丨无关β淀粉样蛋白!科学家们找到了阿尔茨海默病治疗新方向

近日,《自然》子刊Nature Aging发表了一篇关于阿尔茨海默病的重要论文。研究人员们针对阿尔茨海默病的最大风险基因,探明了其在小鼠中的作用机理,并有望带来全新的治疗方法。值得一提的是,这个潜在疗法与流行理论中的β淀粉样蛋白无关,可谓拓展了全新的道路!
众所周知,APOE4等位基因是阿尔茨海默病最大的遗传风险因素。相比携带两条APOE3等位基因的低风险人群,如果普通人携带一条APOE4基因,就能将阿尔茨海默病风险提高4倍。倘若携带两条APOE4基因,风险更是要猛增15倍!
APOE4基因究竟有何能耐,可以对阿尔茨海默病造成如何巨大的影响呢?去年4月,南加州大学Berislav Zlokovic教授团队在《自然》杂志发文,揭开了背后的奥秘:原来这个基因能让大脑的毛细血管周细胞(capillary pericytes)发生退行性病变,加速血脑屏障的破坏。
这让血液里的有毒物质更容易进入大脑,损害脑细胞,从而影响认知功能。而且无论患者有没有出现β淀粉样蛋白,都会出现记忆上的问题。
基于这些发现,Zlokovic教授团队再接再厉,在今日发表的这项研究中进一步探明了APOE4基因破坏周细胞的机理。
研究人员们发现,随着周细胞的破坏,阿尔茨海默病患者血管中的“亲环蛋白A”水平会有所上升,而它恰恰是一种促炎症的蛋白。考虑到最近兴起的阿尔茨海默病“炎症假说”,亲环蛋白A也得到了科学家们的特别关注。
在携带APOE4的小鼠模型中,研究人员们指出亲环蛋白A能激活一种叫做“基质金属蛋白酶A 9”(matrix metalloproteinase 9,缩写MMP9)的酶。这种酶会破坏血脑屏障中的血管,从而破坏血脑屏障。
有趣的是,在携带APOE3的小鼠中,研究人员们并没有观察到这个现象。这也能够解释为何APOE4才是阿尔茨海默病的遗传风险因子。
考虑到亲环蛋白A在周细胞中起到了调控血管完整性的作用,这篇论文的作者们顺理成章地想到,如果能抑制亲环蛋白A,是否就能避免激活MMP9,从而保护血脑屏障的完整性?
为了测试这个想法,科学家们在携带APOE4的小鼠中使用了一种亲环蛋白A抑制剂,而结果恰如他们预料!在抑制剂的作用下,即便携带APOE4基因,小鼠的血脑屏障完整性也能有所改善。
更重要的是,这种抑制剂还能预防神经元的损失,也能预防小鼠行为上出现问题!
综合来看,本研究表明针对亲环蛋白A - MMP9通路的药物有望减缓APOE4基因带来的血管异常与神经退行性症状。这个发现如果能在人体中得到重复,影响是巨大的。
“目前为止,晚期阿尔茨海默病患者还几乎没有任何(治疗)希望,这对患者和他们所爱的人来说是很艰难的一件事,”本研究负责人Zlokovic教授点评道,“我们可能将干预方法集中在血脑屏障修复和血管的强度上,而与淀粉样蛋白病理无关。这有望在晚期阿尔茨海默病中放缓、乃至终止神经退行和认知能力的衰退。能研究这一潜在疗法,我们倍感振奋。”
值得一提的是,本研究中使用的亲环蛋白A抑制剂叫做Debio-025(alisporivir),本身是一种丙肝疗法。未来,人们也将评估它在阿尔茨海默病治疗中的全新潜力。
本文题图:123RF
参考资料:
[1] Montagne, A., Nikolakopoulou, A.M., Huuskonen, M.T. et al. APOE4 accelerates advanced-stage vascular and neurodegenerative disorder in old Alzheimer’s mice via cyclophilin A independently of amyloid-β. Nat Aging 1, 506–520 (2021). https://doi.org/10.1038/s43587-021-00073-z
[2] USC study reveals potential new treatment target for Alzheimer's disease, Retrieved June 14, 2021, from https://www.eurekalert.org/pub_releases/2021-06/ksom-usr061121.php
07
Nature | lncRNA促进PUM蛋白相分离维护基因组稳定性

2021年6月9日, Joshua T. Mendell课题组,在Nature上发表了题为NORAD-induced Pumilio phase separation is required for genome stability 的文章,该文章发现了NORAD可以通过促进PUM蛋白的相分离,从而将其募集到相分离所形成的的“液滴”中,抑制其功能,从而维护基因组稳定性。
更多解读:
作者首先发现NORAD在细胞内会形成点状的聚集,同样,PUM蛋白也形成类似的结构,并且这两种结构具有明显的共定位,作者将这种结构称为NORAD–PUM (NP) bodies。在DNA损伤后,NORAD在细胞内的含量显著增高,NORAD与PUM共定位的“Foci”结构更明显。敲除NORAD后,PUM蛋白便会弥散在细胞内,不再形成“Foci”结构。NP小体结构与已知的相分离形成的P-bodies 以及 stress granules共定位。为了进一步研究NP小体结构的物理化学性质,作者构建了表达内源PUM-GFP的细胞系,作者发现PUM-GFP在NORAD WT的细胞中,形成Foci”结构,但是在NORAD敲除的细胞中,这种结构不再存在,PUM-GFP弥散地分布于细胞内。进一步的研究发现,NP body具有明显的“液滴”的性质,荧光漂白后能够很快地恢复,两个NP body之间能够相互融合。这些结果表明,NORAD与PUM蛋白肯能能够发生相分离形成NP body,通过相分离形成的NP body,NORAD能够将大量的PUM蛋白sequester在“液滴”内部,从而抑制PUM的活性。这可能可以解释低拷贝数的NORAD是如何调控大量的PUM蛋白的活性这一重要的科学问题。
作者进一步在体外对NORAD以及PUM蛋白的相分离现象进行了深入研究,PUM蛋白具有较长的IDR序列,PUM1 和 PUM2都能够在5uM浓度下,即使没有PEG存在情况下发生相分离。为了证实PUM蛋白能够在细胞内的生理浓度条件下是否能够发生相分离。作者对细胞内的PUM蛋白以及NORAD浓度进行了测定,NORAD在细胞内浓度大约在2-6nM,PUM蛋白约50-200nM。作者发现,在生理浓度150nM下,PUM1自身不能发生相分离,但是当加入生理浓度的NORAD后,PUM1发生了明显的相分离现象,说明了NORAD对于PUM1发生相分离具有明显的促进作用。NORAD的捕鱼PUM结合的突变体,即使在高浓度下也无法促进NORAD的相分离。进一步的研究发现,含有4个及以上的PREs (ND4) 的NORAD transcript可以促进PUM蛋白的相分离,低于4个的无法促进PUM的相分离,说明了NORAD促进PUM蛋白相分离具有特异性,依赖于其余PUM蛋白的特异性结合。
作者进一步研究了NORAD促进PUM蛋白发生相分离的机制,作者发现,RNA与PUM蛋白之间多价的相互作用对于NORAD促进PUM蛋白发生相分离是必须的。证实了NORAD相对于其他的具有PRE元件的mRNA的高拷贝数,以及NORAD 具有18个PRE这两种独特的特性,决定了NORAD对于PUM蛋白相分离的促进作用。
作者检测了NORAD与PUM通过相分离形成的NP body是否竞争性地sequester 大量PUM蛋白,从而抑制了PUM与其target mRNA的结合,从而抑制其功能。通过体外的实验,作者证实了在NP body中,一个PRE element可以结合多个PUM蛋白,也就是是说通过相分离形成的NP body,显著地增加了NORAD的PRE对于PUM的募集能力。竞争结合实验进一步证实了NORAD与PUM形成相分离后能够显著地与mRNA竞争结合PUM蛋白,从而抑制其余mRNA相互作用。作者进一步做了定量的分析,发现NORAD中的每个PRE对于PUM的结合能力大约是在其他mRNA中的单个PRE的42倍。
细胞水平的实验进一步证实了以上结果,细胞内的约400个的NORAD提供了7200个PRE,可以竞争302400个单独的PRE,可以sequester细胞内的大约一半到2/3的PUM蛋白到NP body中。作者计算了细胞内大约有13000-325000个PRE存在,因此在数量级上解释了较少的NORAD可以与细胞内的大量的mRNA中的PRE竞争结合PUM蛋白,从而调控PUM蛋白的功能。
IDR–IDR interactions同样能够促进RBP的相分离,作者猜测,NORAD的多个PRE促进了PUM蛋白的相分离,IDR序列的相互作用进一步促进了相分离NP body的形成,从而使大量的PUM蛋白被NORAD募集在NP body中,从而抑制PUM蛋白的功能。作者分别作了与RNA结合的HD 结构域的突变体,以及IDR区域的突变体。作者发现,RNA并不能够促进PUM1Hdmut的相分离,但是WT PUM1与RNA形成的droplets却可以高效地募集PUM1Hdmut进入PUM1与RNA形成的droplets。PUM1WTΔIDR也能够被募集到WT PUM1与RNA形成的droplets中,但是被募集的效率低于WT PUM1. 当HD以及IDR区域都被突变后,将不能在被募集进入PUM1–RNA condensates。这些实验结果进一步在细胞水平得到了验证。
因此,这些实验证实了作者的猜想,即NORAD能够通过多价的相互作用促进PUM的相分离,另一方面形成PUM的IDR区域进一步促进了相分离的形成。
作者进一步验证了是否NORAD对于PUM相分离的促进作用确实将PUM蛋白限制在相分离的液滴中,从而抑制其功能,促进基因组的稳定性。作者发现,当内源的NORAD被抑制后,PUM的target mRNA被显著抑制,当过表达circPRE4–8(大于等于4个PRE)时候,这种抑制作用被消除,而过表达circPRE0–2时候,并无这种效果。另外,在NORAD被抑制表达的细胞中,过表达circPRE0-, or low-valency circPRE1–2的时候细胞在有丝分裂中的chromosome segregation 出现了显著的较多的错误,但是过表达circPRE4 or circPRE8的细胞,这种分裂过程中的不正常的染色体数量显著减少。
综上,作者通过一系列实验,证实了lncRNA NORAD通过促进PUM蛋白的相分离,从而维护基因组稳定性的全新的机制。
RNA通过促进蛋白发生相分离从而维护基因组稳定性这一现象并非首次报道,2019年Nature Cell Biology上就发表了题为 Functional transcription promoters at DNA double-strand breaks mediate RNA-driven phase separation of damage-response factors 的文章,报道了在DNA损伤修复位点产生的RNA可以作为“导火索”促进53BP1的相分离,从而调控DNA损伤修复过程。两篇文章的看似相似的机制,实则不然。这篇文章主旨是RNA通过促进PUM蛋白的相分离将其“围困”在液滴中,从而抑制其活性,维护基因组稳定性。但是NCB的文章是RNA促进了53BP1的相分离,可能为后续相关蛋白的招募提供了一定的反应场所。两篇文章是不同的分子机制。随着研究的深入 ,越来越多的相分离调控DNA损伤修复过程的文章可能会进一步发表,相关的分子机制的研究也会更加深入,对于理解基因组稳定性的维护机制将发挥重要作用。
参考文献:
1. Lee, S., et al., Noncoding RNA NORAD Regulates Genomic Stability by Sequestering PUMILIO Proteins. Cell, 2016. 164(1-2): p. 69-80.
2. Munschauer, M., et al., The NORAD lncRNA assembles a topoisomerase complex critical for genome stability. Nature, 2018. 561(7721): p. 132-136.
08
Cell Metabolism丨DHA有抗癌功能

Omega-3脂肪酸是鱼类和一些植物中存在的不饱和脂肪酸,其中的二十二碳六烯酸(DHA)被认为在增强大脑功能、视力和调节炎症方面起到重要作用。而近日在Cell Metabolism上发表的一项研究显示,DHA和相关脂肪酸还能够起到“毒杀”肿瘤细胞的作用。
比利时鲁汶大学(University of Louvain)的一支研究团队曾经发现,在肿瘤的酸性微环境中的细胞会使用脂质来替代葡萄糖作为能量来源,促进它们的增殖。此前的研究显示,这些细胞的侵袭性很强,具有产生转移瘤的能力。在这项研究中,科学家们对不同类型的脂质对细胞增殖的影响进行了研究。
使用三维肿瘤模型,他们发现在培养基中的不饱和脂肪酸越多,肿瘤细胞越可能因为一种称为铁死亡(ferroptosis)的机制而死亡。铁死亡是近年来受到关注的一种细胞死亡方式,它是由于某些脂肪酸的过氧化导致的细胞死亡。已经有科学研究表明,基于对铁死亡机制的理解,可能开发出强大的抗癌药物。近日获得6000万美元A轮融资的Kojin Therapeutics公司的最初研发重心就是针对耐药性癌细胞中常见的铁死亡敏感状态。
通常在肿瘤的酸性微环境中,细胞会以脂滴(lipid droplet)的形式存储脂肪,防止它们的氧化,而DHA和相关多不饱和脂肪酸会优先在脂滴中积累。当存在大量DHA时,超出肿瘤细胞脂滴存储容量的DHA会出现过氧化,导致细胞的铁死亡。
而且,研究人员发现,如果使用一种抑制细胞生成脂滴的抑制剂处理肿瘤细胞,能够进一步增强DHA引发的铁死亡。
在小鼠肿瘤模型中,他们也发现食用富含DHA的食物能够降低肿瘤的增殖,同时使用脂质代谢抑制剂或诱导铁死亡的化合物能够进一步增强效果。
论文作者表示,这些数据显示,饮食中的多不饱和脂肪酸可能作为一种辅助性抗癌疗法,与抗癌药物起到“相辅相成”的作用。
参考资料:
[1] An omega-3 that's poison for tumors. Retrieved June 15, 2021, from https://www.sciencedaily.com/releases/2021/06/210611110802.htm
[2] Dierge et al., (2021). Peroxidation of n-3 and n-6 polyunsaturated fatty acids in the acidic tumor environment leads to ferroptosis-mediated anticancer effects. Cell Metabolism,https://doi.org/10.1016/j.cmet.2021.05.01609
Sci Adv | 李华兵组发现m⁶A去甲基化酶对CD4+ T细胞功能的重要调控作用

2021年6月16日,来自上海交通大学医学院上海市免疫学研究所李华兵研究员等团队在Science Advances杂志在线发表了题为m6A demethylase ALKBH5 controls CD4+ T cell pathogenicity and promotes autoimmunity 的研究论文,该研究表明 m6A的去甲基化酶ALKBH5在T细胞介导的炎症和自身免疫病中起到以往未被发现的重要作用-可以促进CD4+ T细胞在自身免疫性疾病中的致病性。
目前自然界中已发现两种m6A去甲基化酶:脂肪质量和肥胖相关蛋白(Fat mass and obesity-associated protein,FTO)和烷基化DNA修复蛋白AlkB同源物5(Alkylated DNA repair protein AlkB homolog 5,ALKBH5)。在本研究中,研究团队发现在不同T细胞亚群中Alkbh5的基因表达水平显著高于Fto,且CD4+ T细胞在受到TCR信号激活后其内部的Alkbh5的基因表达水平进一步提升,而Fto的表达水平未见明显改变,提示ALKBH5可能对CD4+ T细胞的功能发挥具有调控作用。随后研究团队通过构建T细胞中ALKBH5条件性敲除小鼠(Alkbh5flox/floxCd4Cre),发现m6A去甲基化酶的缺失虽然不影响T细胞的稳态维持,但该缺陷小鼠来源的naïve CD4+ T细胞几乎丧失了诱导小鼠过继转输性结肠炎的能力。此外,Alkbh5flox/floxCd4Cre小鼠较野生型小鼠其实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)症状减轻。利用EAE模型进行进一步的机制研究表明,ALKBH5的缺失可以显著增强CD4+ T细胞中干扰素-γ (Interferon-γ,IFN-γ)和C-X-C基序趋化因子配体2(C-X-C motif chemokine ligand 2,CXCL2)mRNA上的m6A修饰水平,从而减少了其mRNA的稳定性以及相应蛋白的表达。这种改变不仅削弱了EAE疾病条件下CD4+ T细胞的效应功能,也减少了后续中性粒细胞向中枢神经系统的趋化,从而缓解了神经系统疾病的严重程度。同时,研究团队也构建了T细胞中FTO条件性敲除小鼠(Ftoflox/floxCd4Cre),发现FTO的缺失既不影响T细胞的稳态维持,也不改变EAE的疾病进展,体现了ALKBH5和FTO对CD4+ T细胞功能调控的差异性和选择性。综上所述,该研究揭示了m6A 去甲基化酶ALKBH5对CD4+ T细胞功能的发挥具有重要的调控作用。
据悉,上海交通大学医学院/上海市免疫学研究所博士后周静和张兴利以及上海交通大学附属瑞金医院核医学科胡佳佳为本论文的共同第一作者,上海市免疫学研究所李华兵研究员及耶鲁大学医学院Richard Flavell教授为该文的共同通讯作者。
原文检索:
https://advances.sciencemag.org/content/7/25/eabg0470
10
Nature | 代谢型谷氨酸受体结构揭示C类GPCR二聚化及功能调控机制


2021年6月16日,中国科学院上海药物研究所吴蓓丽研究组、赵强研究组、王明伟研究组和柳红研究组联合中国科学院生物物理研究所孙飞研究组和华中科技大学刘剑峰研究组合作在Nature上以背靠背形式发表了文章Structures of Gi-bound metabotropic glutamate receptors mGlu2 and mGlu4和Structures of human mGlu2 and mGlu7 homo- and heterodimers,在C类GPCR结构与功能的研究领域取得了一系列重要进展:解析了多种人源代谢型谷氨酸受体处于不同功能和不同二聚化状态下的三维结构,包括处于非激活态的mGlu2同源二聚体、mGlu7同源二聚体和mGlu2-mGlu7异源二聚体、处于激活中间态的mGlu2同源二聚体以及处于完全激动态的mGlu2和mGlu4分别与G蛋白的复合物等。此外,他们还解析了mGlu2跨膜结构域分别与两种负性变构调节剂(Negative allosteric modulator, NAM)结合的复合物结构,并在此基础上开展了系统的功能研究。这是首次对代谢型谷氨酸受体从非活化到完全活化状态精细构象变化过程的全面阐释,并揭示了其同源和异源二聚体复杂的信号转导模式,为深入认识该类受体在中枢神经系统中的功能调控机理提供了重要的依据,对于全面认识C类GPCR的信号转导机制具有重大意义。
以往的研究表明,C类GPCR二聚体通过调节两个亚基间的相对构象调控受体的功能。此次,上海药物所的联合研究团队通过解析不同代谢型谷氨酸受体的结构,发现不同受体以不同方式形成同源二聚体将各自构象稳定在非活化状态。与之前测定的mGlu5结构类似,mGlu7的非激活态结构呈现一个完全开放的构象,两个亚基的跨膜结构域之间距离较远,没有直接接触。与此不同,mGlu2二聚体中的两个跨膜结构域彼此靠近,通过各自的第四跨膜螺旋(TM4)形成紧密的相互作用。利用氨基酸突变和细胞信号转导实验,研究人员证实mGlu2中的这一二聚体界面是该受体亚型特有的,对于稳定受体的非活性状态发挥着重要的作用。这一发现展示了该类受体功能调控模式的多样性。
与激动剂结合后,受体由非激活态向激活态转变。基于mGlu2分别处于非激活态、激活中间态和完全激活态的结构,该研究团队首次完整阐释了代谢型谷氨酸受体在整个活化过程中的精细构象变化,为深入理解C类GPCR的激活机制提供了关键信息。受体胞外结构域与激动剂结合后,其构象由开放状态转变为闭合状态,带动跨膜结构域大幅度扭转,使两个亚基间的作用界面从TM4-TM4转换为TM6-TM6对称界面;当受体与G蛋白结合时,跨膜结构域进一步扭转,使其中一个亚基的TM5和TM6与另外一个亚基的TM1、TM6和TM7形成一个非对称二聚体界面。进一步的功能研究表明,这种非对称二聚化对于受体激活至关重要,揭示了受体二聚化对其功能调控的精细机制。研究人员还在mGlu4完全激活态结构中发现了类似的二聚化形式,提示不同代谢型谷氨酸受体可能采用相同的活性调控模式。
该研究的另外一项突破是首次为研究代谢型谷氨酸受体的非对称激活机制提供了直接依据。以往的研究结果显示,只有mGlu二聚体中两个亚基的胞外结构域都与激动剂结合时受体才能被完全激活,但最终只有其中一个亚基的跨膜结构域可与G蛋白偶联,这种非对称信号转导机制一直未被准确阐明。mGlu2和mGlu4与G蛋白的复合物结构显示,受体以形成非对称二聚体的方式使两个亚基处于不同的作用环境,影响它们内部的构象重排,导致仅有一个亚基适于结合G蛋白;此外,G蛋白与其中一个亚基结合后,通过形成空间位阻,阻碍另外一个亚基与G蛋白的结合。
以往的研究结果显示, A类和B类GPCR被激活后,TM6向外大幅度迁移,在受体胞内侧区域形成一个较深的结合口袋与G蛋白结合。与此完全不同,mGlu2和mGlu4与G蛋白结合时,受体的TM6并未向外迁移,G蛋白的C末端斜靠在一个由受体胞内侧环区构成的浅槽内,与其他类型GPCR的G蛋白结合模式差异巨大,充分体现了GPCR信号转导机制的特异性和多样化。
此外,联合研究团队还对mGlu异源二聚体的组装和功能调控机制进行了探索。通过对mGlu2-mGlu7异源二聚体开展结构研究,并结合细胞内信号转导、二硫键交联和荧光共振能量转移实验等多种技术手段,发现在该异源二聚体中mGlu7对于二聚体组装和信号转导发挥主导作用。这是首次为mGlu异源二聚化研究提供的结构信息,对于进一步认识该家族受体异源二聚化分子调控机理奠定了坚实的基础。
其中一篇研究论文的第一作者是中国科学院上海药物研究所博士生林淑玲、副研究员韩硕和实验师蔡晓庆。另外一篇研究论文的第一作者是中国科学院大学杭州高等研究院博士后杜娟、中国科学院上海药物研究所博士生王德健和林淑玲、中国科学院生物物理研究所博士生范宏成和台林华以及华中科技大学讲师许婵娟。该项目主要合作者还包括中国科学院上海药物研究所杨德华研究员和周宇研究员、法国功能基因研究所Jean-Philippe Pin教授和Philippe Rondard教授等。
图片:代谢型谷氨酸受体结构示意图。代谢型谷氨酸受体在神经元兴奋中发挥关键作用,是神经精神系统疾病的重要治疗靶点。图中处于不同功能状态的三个mGlu2结构用绿色飘带图表示,从左上到右下依次为非激活态、激活中间态和完全激活态。完全激活态结构中的G蛋白的三个亚基分别用橙色、灰色和蓝色表示。(图片由中国科学院上海药物研究所吴蓓丽研究组提供)
原文检索:
https://www.nature.com/articles/s41586-021-03495-2
https://www.nature.com/articles/s41586-021-03641-w
11
Sci Adv | 液滴微流控系统加速双抗及激动型抗体等新一代肿瘤免疫抗体的开发

近日,南开大学张宏恺课题组与高诚生物医药有限公司、上海科技大学及上海交通大学合作在Science Advances期刊上发表题为High throughput functional screening for next generation cancer immunotherapy using droplet-based microfluidics的文章,研究团队开发了一种基于液滴微流控系统的高通量功能型抗体筛选方法,有效的实现了基因型和活性表型的耦合,使得从百万种多样性的抗体中快速筛选活性抗体成为可能,且节约了人力和资金的投入,将能够促进下一代肿瘤免疫疗法药物的开发。
PD-1/PD-L1免疫检验点拮抗型抗体在肿瘤免疫治疗领域取得突破性进展【1】,近年来双特异性抗体T细胞接合器(T Cell Engager)和靶向共刺激受体的激动型抗体迎来了开发的浪潮【2-4】。然而,免疫激动型抗体的开发具有很大的挑战,需要综合抗体亲和力、表位、效价、簇形成、Fcγ受体相互作用、受体占用率等多方面的考虑【5】。
生物科技支柱技术噬菌体展示技术巧妙的实现了蛋白表型和基因型的偶连,从而可以基于亲和力对上亿种分子进行高效筛选【6】。激活型抗体的筛选只能依赖于对几千个抗体逐个纯化、表达和和检测,因此药物研发领域迫切需要开发一种高通量的激活型抗体筛选方法。
研究团队开发了基于液滴微流控系统的高通量功能型抗体筛选技术(图1),首先构建慢病毒抗体文库并用该文库感染细胞,每个细胞仅被一个病毒感染从而每个细胞分泌一种抗体;之后通过液滴微流控系统将单个抗体分泌细胞与单个报告细胞共包裹在同一个微液滴中,每一个液滴相当于一个独立的微型反应器,互不影响;细胞在液滴中培养后,通过荧光激活液滴分选(FADS)系统,分选出含有激活报告细胞的液滴,液滴微流控系统可以在数小时实现对数百万个液滴的生成和分选;随后,从液滴中回收抗体分泌细胞、扩增并进行下一轮筛选;经过多轮筛选后从富集细胞中提取抗体基因进行测序,从而确定活性抗体的序列。
研究人员利用基于液滴微流控系统的高通量功能型抗体筛选技术筛选CD40受体的激动型抗体。经过两轮筛选后,研究人员对初始文库和两轮筛选后的抗体库进行三代测序及生物信息学分析,发现一些抗体实现了逐轮的富集,对富集程度最高的5个抗体进行表达纯化和验证发现5个抗体都是CD40的强激动型抗体。研究人员利用该方法筛选出了初始频率仅有0.02%的活性抗体,而初始文库中比例很高的无活性抗体在筛选过程中被逐轮淘汰。值得一提的是,基于该平台筛选出的CD40激动剂抗体C04,在小鼠模型中有效激活免疫系统并抑制肿瘤生长,未经任何优化的C04抗体的安全性和有效性均媲美临床试验中的CD40激动型抗体CP870893。另外,研究人员利用该方法经过一轮筛选即获得多个anti-Her2×anti-CD3双特异性抗体T细胞接合器。
该论文报道了一种基于液滴微流控系统的高通量功能型抗体筛选方法,有效的实现了基因型和活性表型的耦合,使得从百万种多样性的抗体中快速筛选活性抗体成为可能,且节约了人力和资金的投入,将能够促进下一代肿瘤免疫疗法药物的开发。同时,该研究范式将能够应用于多肽和细胞因子改造、细胞间通讯和TCR与新生抗原配对等多方面的研究。
南开大学助理研究员王媛博士和博士生晋瑞娜为论文共同第一作者,高诚生物沈冰清博士和上海科技大学王玮博士做出了关键贡献。
原文链接:
https://advances.sciencemag.org/lookup/doi/10.1126/sciadv.eabe3839
参考文献
[1] Andrews LP, Yano H, Vignali DAA. Inhibitory receptors and ligands beyond PD-1, PD-L1 and CTLA-4: breakthroughs or backups. Nat Immunol. 2019 Nov;20(11):1425-1434. doi: 10.1038/s41590-019-0512-0. Epub 2019 Oct 14. PMID: 31611702.
[2] Mayes PA, Hance KW, Hoos A. The promise and challenges of immune agonist antibody development in cancer. Nat Rev Drug Discov. 2018 Jul;17(7):509-527. doi: 10.1038/nrd.2018.75. Epub 2018 Jun 15. PMID: 29904196.
[3] Vonderheide RH. CD40 Agonist Antibodies in Cancer Immunotherapy. Annu Rev Med. 2020 Jan 27;71:47-58. doi: 10.1146/annurev-med-062518-045435. Epub 2019 Aug 14. PMID: 31412220.
[4] Labrijn AF, Janmaat ML, Reichert JM, Parren PWHI. Bispecific antibodies: a mechanistic review of the pipeline. Nat Rev Drug Discov. 2019 Aug;18(8):585-608. doi: 10.1038/s41573-019-0028-1. PMID: 31175342.
[5] Garber K. Immune agonist antibodies face critical test. Nat Rev Drug Discov. 2020 Jan;19(1):3-5. doi: 10.1038/d41573-019-00214-5. PMID: 31907434.
[6] Lerner RA. Manufacturing immunity to disease in a test tube: the magic bullet realized. Angew Chem Int Ed Engl. 2006 Dec 11;45(48):8106-25. doi: 10.1002/anie.200603381. PMID: 17120282.
12
Nat Immunol | 宋尔卫/苏士成团队揭示促进T细胞进入肿瘤新策略

2021年6月17日,中山大学孙逸仙纪念医院宋尔卫/苏士成课题组在Nature Immunology上在线发表了题为Targeting Regulator of G-protein Signaling 1 in Tumor-specific T cells Enhances Their Trafficking to Breast Cancer 的研究论文,发现抗肿瘤的CTL和Th1细胞的迁移至肿瘤的能力明显弱于免疫抑制的Th2和Tregs细胞。机制是CTL和Th1细胞中IFN-STAT1通路转录上调了RGS1(regulator of G protein signaling),RGS1抑制CTL和Th1迁移到肿瘤局部的能力。靶向RGS1可增加抗肿瘤T细胞的浸润,并增强免疫治疗的效果。
肿瘤免疫治疗获得18年诺贝尔医学奖,是目前发展最快的肿瘤治疗之一。但目前只有大约20-30%患者获益,因此寻找新的免疫治疗靶点有重要意义。抗肿瘤特异免疫反应大致可以分7个步骤:1)肿瘤抗原释放;2)抗原提呈;3)T细胞在引流淋巴结的教育和激活;4)T细胞迁移至肿瘤;5)T细胞穿过血管进入肿瘤;6)T细胞识别肿瘤细胞;7)T细胞杀伤肿瘤细胞(图1)。目前肿瘤免疫治疗的靶点都是针对不同的步骤,例如PD-1/PD-L1抗体针对7);CTLA-4抗体针对3);CAR-T针对6);肿瘤疫苗针对2)等(图1)。但是,抗肿瘤特异免疫反应中唯一没有效药物覆盖的就是步骤4)促进T细胞迁移(图1)。
然而,肿瘤组织极少有抗肿瘤T细胞存在又是一个非常普遍的临床现象。大量研究报道,实体肿瘤免疫抑制的重要原因是无或极少T细胞浸润(例如“免疫沙漠”)。即便有T细胞浸润也是以促肿瘤的Th2或者Tregs为主。对于其潜在机制,既然研究主要认为幼稚T细胞更多地被诱导分化为免疫抑制的T细胞(Treg, Th2),细胞毒性T淋巴细胞CTL(cytotoxic T lymphocytes )和Th 1更易被诱导凋亡等。除此之外,是否还存在着其他调控肿瘤T细胞亚群数量尚不清楚,特别是抗癌/促癌T细胞亚群迁移到肿瘤能力是否有差异目前缺乏报道。
该研究发现肿瘤微环境中,抗肿瘤淋巴细胞(Th1和CTL)浸润少、免疫抑制型淋巴细胞(Th2)浸润多的患者预后明显较差,而造成这一现象的原因之一,是Th1和CTL迁移到肿瘤局部的能力明显弱于Th2细胞,且不依赖于趋化因子及其受体的表达水平。这提示是T细胞中趋化因子受体的功能受损而不是受体的表达水平。
趋化因子受体多为G蛋白偶联受体(G protein-coupled receptor, GPCR),趋化因子与GPCR结合后,Gα亚基核苷酸结合位点的GDP转换为GTP,激活异源三聚体G蛋白使之分离成Gα和Gβγ,进而调节胞内的信号通路。而RGS(Regulator of G-protein Signaling)家族蛋白属于GTP酶激活蛋白 (GTPase accelerating proteins, GAPs),通过加速Gα亚基上的GTP水解成为GDP使下游通路的进入失活状态。在乳腺癌患者的外周血中发现Th1和CTL高表达RGS1,且与其在肿瘤局部的浸润呈负相关,与患者的不良预后相关。进一步机理研究发现,RGS1通过与趋化因子受体CXCR3,CXCR4以及CCR4结合,抑制了这些GPCR下游的钙离子通路的激活,从而抑制了ERK和AKT信号通路,使CTL和TH1的迁移能力受损。沉默RGS1后,可恢复GPCR下游通路的激活,促进CXCL9,CXCL10,CXCL11,CXCL12等趋化因子对CTL和Th1细胞的募集。
进一步探索其机制,该课题组发现RGS1的转录受IFNγ-STAT1通路调控。既往研究报道,在肿瘤及其微环境中,IFNγ-STAT1通路的激活可引起大量趋化因子的表达,如CXCL9, CXCL10, CXCL11等,这些趋化因子可募集CTL和Th1细胞到肿瘤局部。但是,在免疫细胞中,IFNγ-STAT1通路的激活除了放大肿瘤局部的炎症反应,还会转录出许多免疫检查点分子的表达,如PD-L1, IDO等,作为负反馈方式抑制T细胞活性。而在本研究中,本研究还发现CTL和TH1细胞的IFNγ-STAT1通路被激活,RGS1被大量转录,抑制了CTL和TH1细胞通过循环系统向肿瘤迁移的能力。而TH2细胞中,STAT1活性低,RGS1转录少,TH2细胞的迁移能力未受影响,此消彼长,是乳腺癌形成抗肿瘤T细胞浸润少、促肿瘤T细胞浸润多这一免疫“冷”表型的重要原因之一(图2)。
进一步本研究通过构建小鼠乳腺癌、肺癌模型,并回输沉默RGS1的肿瘤特异CTL,本研究发现回输沉默RGS1的CTL可有效增加CTL在肿瘤局部的浸润,从而增强其杀伤功能,肿瘤明显缩小。另一方面,为了最大程度的模拟病人的肿瘤微环境以及避免同种异体反应,该研究选用了人源肿瘤异种移植(Patient-derived xenograft, PDX)模型,单独或联合运用免疫检查点抑制剂PD-L1单抗及过继性细胞治疗,模拟病人免疫治疗的过程。本研究发现单用PD-L1抑制剂效果欠佳,而回输沉默RGS1的T细胞治疗可使肿瘤浸润的T细胞明显增多,使“冷肿瘤”变为“热肿瘤”,再联合PD-L1抑制剂可获得更好的治疗效果。
据悉,宋尔卫院士、苏士成研究员是本论文的共同通讯作者,黄迪医师、陈雪曼博士后、曾欣博士是本文的共同第一作者。
原文检索:
https://www.nature.com/articles/s41590-021-00939-9
其他最新文章推荐
IL-6 regulates autophagy and chemotherapy resistance by promoting BECN1 phosphorylation

ZNRF3 and RNF43 cooperate to safeguard metabolic liver zonation and hepatocyte proliferation

A single-cell-resolution fate map of endoderm reveals demarcation of pancreatic progenitors by cell cycle

资料根据公开数据搜集整理
资料整理:西湖生物医药综合办公室
文章来源:公开信息搜集
