关注生命科学领域突破进展,聚焦热点政策,观澜创新治疗产品行业动态,耕耘于分秒,收获于细微,做乘风破浪的生物医药人!

01
关于公开征求《溶瘤病毒产品药学研究与评价技术指导原则(征求意见稿)》意见的通知
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=e2d661b43492694d
02
国家药品监督管理局药品审评检查长三角分中心、大湾区分中心关于启动一般性技术问题解答工作的通知
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=eafa0ebdc7c78968
03
关于公开征求《抗HIV感染药物临床试验技术指导原则(征求意见稿)》意见的通知
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=0166e0837be086f2
01
“无癌生存”时间翻倍!重磅PD-1抑制剂获FDA优先审评资格
5月1日,百时美施贵宝(Bristol Myers Squibb, BMS)宣布,美国FDA已受理重磅PD-1抑制剂Opdivo(nivolumab)的补充生物制品许可申请(sBLA)。作为辅助疗法,治疗接受根治性膀胱切除术的高复发风险肌层浸润性尿路上皮癌患者。美国FDA同时授予这一申请优先审评资格,预计在今年9月3日之前做出回复。新闻稿指出,如果获得批准,Opdivo可能成为面向肌肉浸润性尿路上皮癌患者的首个辅助免疫治疗选择。
02
降低死亡风险31%,达格列净今日获FDA批准治疗慢性肾病
5月1日,美国FDA宣布,批准阿斯利康(AstraZeneca)公司开发的SGLT2抑制剂达格列净扩展适应症,用于治疗慢性肾病成人患者,缓解肾功能下降,以及降低肾衰竭、心血管死亡和因心力衰竭住院的风险。这也是达格列净在获批治疗2型糖尿病和心力衰竭之后,斩获的又一项重要适应症。在中国,它在今年2月也获得批准治疗心力衰竭患者。
03
多特异性抗体成趋势!百利药业第三款四特异性抗体申报临床
5月1日,根据国家药监局药品审评中心(CDE)官网,四川百利药业有限责任公司申报的“GNC-035四特异性抗体注射液”临床试验申请获得受理(受理号:CXSL2101045)。

04
靶向治疗胆管癌,口服IDH1抑制剂获FDA优先审评资格
5月5日,施维雅(Servier Pharmaceuticals)宣布,美国FDA已接受该公司为Tibsovo(ivosidenib片剂)递交的补充新药申请(sNDA),作为治疗携带异柠檬酸脱氢酶-1(IDH1)突变的经治胆管癌患者的潜在疗法。FDA同时授予这一申请优先审评资格,这将审评时间从10个月缩短到6个月。
05
一线胃癌治疗再传喜讯,Keytruda组合疗法获FDA加速批准
5月6日,默沙东(MSD)公司宣布,美国FDA已加速批准其抗PD-1疗法Keytruda与曲妥珠单抗(trastuzumab)和含氟嘧啶和铂类化疗联用,一线治疗局部晚期不可切除或转移性HER2阳性胃癌或胃食管连接部(GEJ)腺癌患者。新闻稿指出,这是首个获批与曲妥珠单抗和化疗联用,一线治疗这一患者群体的抗PD-1疗法。这是继今年4月,百时美施贵宝(BMS)公司的重磅PD-1抑制剂Opdivo(nivolumab)获批与化疗联用,一线治疗胃癌患者后这一领域的又一重要进展。
06
首个NMOSD治疗药物即将在华获批上市
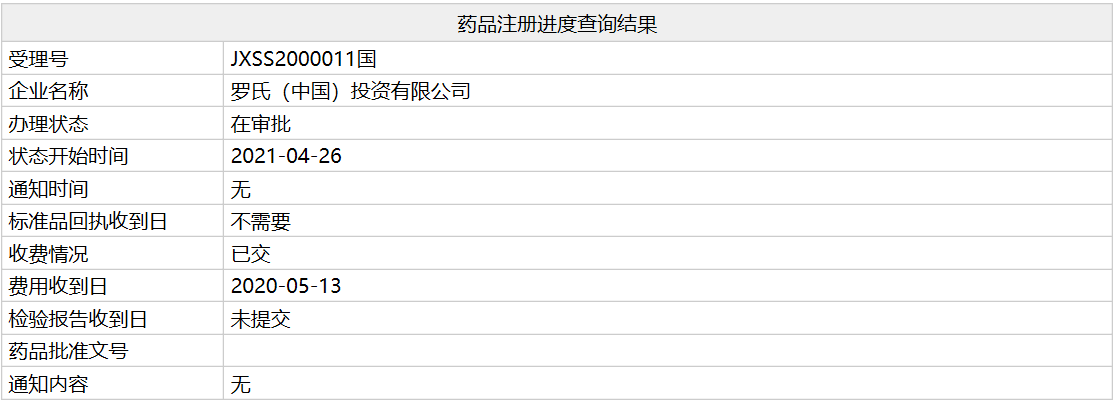
近日,国家药监局官网显示,罗氏罕见病视神经脊髓炎谱系疾病(NMOSD)治疗药物satralizumab的上市申请(受理号:JXSS2000011)已处于“在审批”阶段,将于近期获得NMPA批准上市。
07
百济神州PARP抑制剂「帕米帕利」即将获批上市
近日,国家药监局官网显示,百济神州提交的PARP1/2抑制剂帕米帕利上市申请(受理号:CXHS2000021)已处于“在审批”阶段,有望近期获得NMPA批准上市,适用于存在已知致病或疑似致病的胚系BRCA突变的既往接受过两线或两线以上化疗的晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。这将会是国内获批上市的第4款PARP抑制剂。
08
武田戈谢病新药获批进入中国,为中国患者带来生命新希望
5月1日,武田中国宣布,旗下维葡瑞®注射用维拉苷酶α)经中国国家药品监督管理局批准,适用于1型戈谢病患者的长期酶替代治疗(ERT)。维葡瑞®(注射用维拉苷酶α)是在连续人类细胞系中通过基因活化技术生产的葡萄糖脑苷脂酶,具有与天然人类葡萄糖脑苷脂酶相同的氨基酸序列1,2 ,在治疗早期就可改善儿童和成人患者的贫血、血小板减少等症状、缩小因病肿大的肝脏和脾脏体积、改善相关骨骼疾病,并在后期持续改善或稳定患者症状3,4 。得益于相关政府部门的加快审评和审批,维葡瑞®(注射用维拉苷酶α)是武田在中国短短一年左右内获批的第5款罕见病领域的创新产品,将为中国戈谢病患者带来生命新希望。
09
和黄医药在美国提交首个NDA,索凡替尼迎新进展!
5月3日,和黄医药宣布已完成向美国FDA滚动提交索凡替尼(surufatinib)的新药上市申请(NDA),用于治疗胰腺和非胰腺神经内分泌瘤。根据新闻稿,这是和黄医药在美国提交的首个新药上市申请。
10
FDA接受安进银屑病药物Otezla的补充新药申请
日前,安进宣布,美国FDA已经接受并审查安进Otezla (apremilast)用于治疗适合进行光疗或全身疗法、轻度至中度斑块状牛皮癣成年患者的补充新药申请(sNDA)。FDA已将该申请的《处方药使用者费用法案》PDUFA日期初步设定为2021年12月19日。
11
罗氏Tecentreq单药一线治疗非小细胞肺癌获欧盟批准
5月5日,罗氏宣布,欧盟委员会已经批准了Techentriq® 作为肿瘤具有高PD-L1表达、没有表皮生长因子受体(EGFR)或间变性淋巴瘤激酶(ALK)基因组肿瘤畸变的转移性非小细胞肺癌(NSCLC)的一线(初始)治疗药物。
12
基石药业精准靶向药阿伐替尼在中国台湾获批
近日,业内传来消息,基石药业的胃肠道间质瘤(GIST)精准靶向药物阿伐替尼片已经在中国台湾地区获批,用于治疗携带PDGFRA D842V突变无法切除或转移性胃肠道间质瘤成人患者。
13
奥赛康药业新一代三唑类抗真菌药获批
近日,中国国家药监局(NMPA)公示,奥赛康药业以注册分类3类仿制药递交上市申请的泊沙康唑注射液,已正式获得批准。根据NMPA药品审评中心(CDE)优先审评公示,该申请适应症为:预防侵袭性曲霉菌和念珠菌感染。

14
儿童用药!人福药业咪达唑仑口服溶液获批
近日,中国国家药监局(NMPA)公示,人福药业以注册分类3类仿制药递交上市申请的咪达唑仑口服溶液,已正式获得批准。根据NMPA药品审评中心(CDE)优先审评公示,这是一款儿童用药,规格为10ml:20mg,适应症为:适用于儿童患者在诊断、治疗、内窥镜手术前或麻醉诱导前的镇静、抗焦虑和遗忘。

15
罗氏血友病新药「艾美赛珠单抗」新适应症上市申请进入“在审批”
近日,中国国家药监局(NMPA)药品注册进度查询结果显示,罗氏(Roche)提交的艾美赛珠单抗注射液(emicizumab)新适应症上市申请,其办理状态已更新为:在审批,这意味着该新适应症有望近期在中国获批。根据NMPA药品审评中心(CDE)优先审评公示,该申请适应症为:适用于不存在凝血因子VIII抑制物的A型血友病患者。
16
Keytruda组合疗法斩获两项优先审评资格,治疗肾细胞癌和子宫内膜癌
近日,5月6日,默沙东(MSD)与卫材(Eisai)宣布,美国FDA已受理为抗PD-1药物Keytruda/口服酪氨酸激酶抑制剂Lenvima组合递交的两项补充新药申请(sNDA),分别用于一线治疗肾细胞癌和二线治疗晚期子宫内膜癌患者。FDA同时授予这两项sNDA优先审评资格,预计在今年8月底至9月初做出回复。
17
首个PD-1/TGFβ双抗获批临床:君实生物JS201
5月6日,君实生物JS201的临床实验申请获得NMPA的默示许可。JS201为全球首个进入临床阶段的PD-1/TGFβ双抗。国内维立志博的PD-1/TGFβ双抗LBL-015也已经申报临床,为君实生物之后第2款。

18
百奥泰申报第2款TIGIT抗体
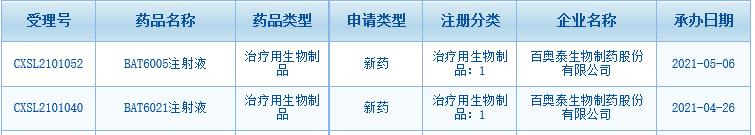
5月6日,百奥泰TIGIT抗体BAT6005的临床实验申请获得NMPA受理,这是10天内百奥泰申报的第2款TIGIT抗体。4月26日,百奥泰另一款TIGIT抗体BAT6021的临床试验申请已经获得受理。
19
加科思药业KRAS G12C抑制剂在美国获批临床
近日,加科思药业宣布,公司在研项目KRAS G12C抑制剂JAB-21822新药临床试验申请(IND)已在美国获批。加科思药业将展开针对非小细胞肺癌和结直肠癌肿瘤患者的临床试验,并计划于2021年下半年在中国和美国两地启动患者入组。

优于获批DMD疗法,新一代寡核苷酸疗法2期临床结果积极
5月3日,Sarepta Therapeutics宣布,其用于治疗杜氏肌营养不良(DMD,Duchenne muscular dystrophy)患者的新一代反义寡核苷酸疗法SRP-5051,在一项全球性、剂量递增的2期临床试验中获得积极结果。试验结果表明,新一代疗法可以基于更低的给药频率提供更高的疗效。基于这一结果,该公司计划与美国FDA展开讨论,以进行支持加速批准的关键性临床试验。
78%患者获得完全缓解,IL-15超级激动剂组合早期临床结果积极
5月4日,ImmunityBio公司宣布,其IL-15超级激动剂复合体Anktiva(N-803)联合抗CD20单克隆抗体疗法Rituxan (利妥昔单抗),在治疗CD20敏感性惰性非霍奇金淋巴瘤(iNHL, indolent non-Hodgkin lymphoma)患者时达到78%的完全缓解率。这项1期临床试验结果发表在Clinical Cancer Research上。
武田10.4亿美元达成合作的RNAi疗法公布最新临床数据!能够消退肝脏的纤维化程度
近日,Arrowhead Pharmaceuticals宣布,在RNAi候选疗法ARO-AAT针对α-1抗胰蛋白酶缺乏症相关肝病(AATLD)的临床研究AROAAT2002中取得了阳性积极结果。
ARO-AAT是Arrowhead与武田共同开发的第二代皮下给药RNAi疗法,旨在抑制突变的α-1抗胰蛋白酶(Z-AAT)蛋白在肝脏的产生,以治疗AATLD。Z-AAT是AATLD发生的原因,减少炎症性Z-AAT蛋白的产生有望阻止肝病的进展,并可能使其再生和修复。
茂行生物新型CAR-T治疗脑胶质瘤临床研究取得突破性进展
胶质瘤是目前所有肿瘤中最难攻克的恶性肿瘤之一,预后极差,严重危害生命健康。近日从苏州大学附属第一医院神经外科主任医师、苏州大学医学中心(苏州大学附属独墅湖医院)神经外科主任黄煜伦教授处获悉:在黄煜伦团队和合作单位的共同努力合作下,经过两年多的研究者发起临床试验,最近,三例复发的晚期胶质母细胞瘤患者呈现了100%的客观有效率。通过2-6个疗程新型CAR-T细胞治疗,核磁共振显示:1例患者呈现完全有效(CR),即肿瘤完全消失,截止发稿日,CR已持续5个半月。两例患者呈现部分有效(PR),肿瘤缩小在40%-80%之间。入组时间最长的一位患者在复发后已经存活超过22个月(复发胶质瘤患者平均生存期为6个月左右),并且目前情况良好。这些研究成果为晚期复发胶质瘤患者带来了曙光,也代表着一个重要的里程碑。
三例患者在接受苏州茂行生物的新型CAR-T细胞治疗后,仅出现持续3-6天的发热、呕吐等症状,未见三级以上毒副作用,获得优异疗效的同时展示了良好的安全性。
多发性硬化疗法临床试验新进展
多发性硬化症(MS)是最常见的一种中枢神经脱髓鞘疾病。本病急性活动期中枢神经白质有多发性炎性脱髓鞘斑,陈旧病变则由于胶质纤维增生而形成钙化斑,以多发病灶、缓解、复发病程为特点,好发于视神经、脊髓和脑干,多发病于青、中年,女性较男性多见。
Anokion是一家专注于通过恢复正常免疫耐受治疗自身免疫性疾病的瑞士生物技术公司,该公司前不久宣布,其1期临床试验开始患者给药,以评估ANK-700治疗复发缓解型多发性硬化症(relapsing remitting multiple sclerosis,RRMS)患者的疗效。MoveS-it研究(ANK-700治疗多发性硬化研究,评估其安全性和免疫耐受性)是一项随机、双盲、安慰剂对照的首次人体研究,旨在评估单次和多次递增剂量ANK-700的安全性和耐受性。
THE LANCET:三特异性纳米抗体治疗银屑病取得积极成果
近日,Avillion公司在THE LANCET(柳叶刀)上发表了其三特异性纳米抗体Sonelokimab(M1095)在斑块状银屑病的2期临床结果,所有主要和次要终点均达到指标。
Sonelokimab(也称为M1095)是一种三特异性半衰期延长的纳米抗体,可以中和IL-17A和IL-17F,并具有治疗炎性疾病的潜力。由于Nanobodies®的体积小和独特的结构,它们可能成为新一代新型生物药物的理想构建基块。
BCMAxCD3双特异性抗体遭遇安全问题,辉瑞暂停elranatamab二期临床患者入组
今年2月,辉瑞将elranatamab推进至关键2期临床试验,这是基于在1期临床试验MagnetisMM-1中治疗的20例患者中所观察到的80%总缓解率数据。然而,在对首批复发和难治性多发性骨髓瘤(MM)患者进行给药治疗后,辉瑞已暂停了该项2期研究,以便有时间收集关于安全信号的信息。该暂停是由于在MagnetisMM-1试验中发现了3例周围神经病变病例。截至去年底,辉瑞已有30例患者的1期临床数据,但在当时更新数据时,2期研究的患者招募仍在继续,目标是入组80例患者。
部分数据公布!在研乙肝新药ASC22 IIa期试验取得良好结果
5月5日, 歌礼制药有限公司宣布,公司旗下一款在研药物 —— ASC22(恩沃利单抗)在慢性乙型肝炎患者中进行的 Phase IIa 期研究中取得良好结果。研究观察到乙肝表面抗原呈剂量依赖性下降趋势;在2.5 mg/kg单次给药队列(患者人数=3)中,一名患者的乙肝表面抗原(HBsAg)下降1.2 log10 IU/mL。
17亿美元赌注!LRRK2抑制剂治疗帕金森病I/Ib期结果公布
5月1日,Denali Therapeutics宣布了小分子LRRK2抑制剂DNL151/BIIB122治疗帕金森病的I/Ib期研究的结果。研究达到了安全性和生物标志物的主要终点,为2021年底将DNL151推进至后期临床阶段提供了证据支持。研究结果在国际帕金森病和相关疾病协会的虚拟联合会上发表。

01
Cell丨揭示最全面的肿瘤内异质性图谱

肿瘤内异质性 (intra-tumor heterogeneity, ITH) 一直是癌症治疗的难题。ITH越高,越容易耐药,癌症进展越快,预后越差。这就像生态系统一样,越多样越强大,越不易消亡。
要解决这个临床上的挑战,首先得深入了解对手情况,比如肿瘤内异质性是什么样的,不同癌症有什么异同等等。以前的研究多是分析外显子测序数据 (exome sequencing) ,但这种方法有很大的局限性,因为外显子只占整个基因组的不到2%,并不能显示异质性的全貌。全基因组测序才能更好地反映肿瘤内异质性的状态。
近日,Pan-Cancer Analysis of Whole Genomes (PCAWG)工作组在Cell杂志上发表了最新的肿瘤内异质性的研究工作:Characterizing genetic intra-tumor heterogeneity across 2,658 human cancer genomes,通过分析38种癌症的2,658个肿瘤的全基因组测序数据,深入阐释了肿瘤的异质性图谱。
更多解读:
全基因组测序能提供有关肿瘤基因组的丰富信息,包括:
· Single-nucleotide variants (SNVs),单核苷酸突变
· Insertions or deletions (Indels),插入和缺失突变
· Copy number alterations (CNAs),拷贝数变异
· Structural variants (SV),结构变异
· Tumor purity,肿瘤纯度
· Subclonal drivers,亚克隆驱动变异
· Subclonal selection,亚克隆的选择
· Mutation signature,突变指纹图谱
他们有什么发现呢?
亚克隆扩张(subclonal expansion)在绝大多数癌症里都很常见。几乎所有的肿瘤里(95.1%)都有亚克隆扩张。除了皮肤癌,在其他的癌症里,至少75%的样本里都检测到了亚克隆扩张。考虑到全基因组测序的平均测序深度只有46X,并且很多肿瘤只测了一个样本,实际情况里肿瘤的亚克隆会更常见。亚克隆SNVs、Indels、SVs和CNAs的比例在不同癌症类型中变化很大。例如,亚克隆SNVs的比例在鳞状细胞癌里通常较低,而在嗜铬细胞癌和星形细胞瘤里较高。亚克隆的分支进化很常见。除了刻画每个肿瘤的亚克隆变异的图谱,对有足够信息的肿瘤,研究者们还推测出了亚克隆之间的关系:是线性的“亲子”关系,还是类似“兄弟姐妹”的分支关系?结果发现两种都很常见。分支进化即使在突变负荷低的肿瘤里也能观察到。
刻画完亚克隆的变异特征,研究者又分析了一个有趣的问题:亚克隆的突变是怎么造成的呢?背后有什么生物学过程的参与?研究者们分析了肿瘤里的突变指纹图谱 (Mutation signature) 。什么是突变指纹图谱呢?简单来说,每个致癌过程,不论是外在的烟草、紫外线,还是内在的DNA修复出了问题,造成的DNA突变都有一定的特征,可被算法识别。肿瘤里的突变是所有这些致癌过程在时间和空间上的叠加混合。
研究者们发现平均每个肿瘤样本中有1.77个突变指纹图谱,并且,克隆和亚克隆之间的突变指纹图谱很稳定。当然变化也是有的,并且在有的肿瘤里,突变指纹图谱的变化反应了癌症的进化史,比如:
和紫外线有关的SBS7突变指纹在黑色素瘤的克隆突变里很明显,在亚克隆突变里就减少了,说明癌症已经进展到了紫外线接触不到的深层皮肤。
在和吸烟有关的肺癌里,比起克隆突变,亚克隆突变的吸烟相关突变指纹(SBS4)减少,而另一种突变指纹增加(SBS2/13,APOBEC),表明肿瘤的发生是被烟草致癌物诱发的,而后期则有更多的细胞内在过程的参与。
他们还发现,突变指纹图谱的变化和克隆/亚克隆的肿瘤细胞纯度变化点相吻合,这进一步暗示,造成亚克隆扩张的是各种致癌突变过程。此外,dN/dS比值分析显示,亚克隆中正向选择很常见。这一结果支持肿瘤的克隆进化模型:肿瘤细胞的基因组不稳定,在复制过程中,一些子细胞产生了有利于生存的突变,这一优势使得它们被正向选择,成为新的亚克隆的先驱。这些有利于生存的突变被称为亚克隆驱动变异(subclonal driver),他们的分析显示,驱动亚克隆扩张的变异在各个癌症里也差别很大。并且,所有亚克隆中只有11%携带已知的SNVs或Indels驱动突变,晚期肿瘤的发展可能主要是由不同的机制(比如CNAs和SVs,或表观遗传学改变)驱动的。肿瘤进化是一个复杂过程,不同的克隆和亚克隆在时间和空间的维度受到多种因素的影响,需要更大规模的、包括单细胞的、多组学的研究,才能更深入地阐释肿瘤内异质性和肿瘤进化史。这一项包括38种癌症类型的两千多个肿瘤全基因组的亚克隆重构,在这一领域迈出了重要的一步,为未来的肿瘤全基因组数据的分析提供了最佳实践和丰富资源。
原文检索:Characterizing genetic intra-tumor heterogeneity across 2,658 human cancer genomes
02
Cell Metab | 徐萌/杨财广/韩大力团队联合揭示FTO调控肿瘤免疫逃逸新机制

CD8+ T细胞是机体识别与杀伤肿瘤细胞的关键免疫细胞,其功能却常常被复杂的肿瘤微环境所抑制,最终导致肿瘤逃逸免疫监视。因此,如何更有效地增强T细胞介导的抗肿瘤免疫应答,令机体形成长期的免疫记忆,是阻止肿瘤恶化及复发的关键。旨在恢复CD8+ T细胞功能的PD-1/PD-L1阻断抗体疗法在部分肿瘤患者中取得了很好的疗效,但大部分病人仍不能很好地响应现有的免疫疗法。前期研究表明,肿瘤细胞可利用多种表观修饰机制逃逸免疫监视,进而导致对免疫治疗的不敏感。m6A是真核细胞中mRNA上丰度最高的修饰类型,影响mRNA的稳定性及翻译等过程。近期的工作指出,m6A修饰的去甲基酶FTO高表达可促进多种癌症的发生发展过程。然而,肿瘤细胞中的FTO是否能够参与调节肿瘤免疫微环境,调控T细胞介导的免疫监视,目前仍然不清楚。
2021年4月27日,清华大学免疫研究所徐萌团队,中科院上海药物研究所杨财广团队、中科院北京基因组研究所韩大力团队合作在Cell Metabolism上发表了题为Tumors exploit FTO-mediated regulation of glycolytic metabolism to evade immune surveillance 的研究论文,揭示了肿瘤通过表观转录组层面调控免疫逃逸的机制:肿瘤细胞的FTO通过擦除bZIP家族转录因子的m6A修饰以维持其mRNA水平,进而上调糖酵解相关基因的转录,增强肿瘤细胞糖酵解代谢,最终抑制T细胞的激活和功能。
更多解读:
这项研究发现,在不同实体瘤细胞中敲低FTO的表达会抑制肿瘤在小鼠体内的生长,并增加肿瘤中浸润的抗原特异性CD8+ T细胞的比例。进一步的研究表明,在肿瘤中敲低FTO会使CD8+ T细胞更快地激活,更有效地执行杀伤肿瘤细胞的功能。
通过对RNA-seq、MeRIP-seq (m6A-seq)、ATAC-seq、ChIP-seq等多维组学测序数据的整合分析发现,FTO可调控多个bZIP家族转录因子的m6A修饰,促进其mRNA稳定性。这些bZIP家族转录因子能促进糖酵解基因的表达,增强肿瘤细胞糖酵解活性,进而抑制CD8+ T细胞的激活。
研究者以靶向FTO的小分子抑制剂Dac51为小分子工具,进一步验证了在实体瘤中干预FTO的免疫治疗效果。Dac51能特异地抑制FTO的去甲基化酶活性,抑制肿瘤细胞的糖酵解代谢,其处理与敲低Fto基因的表型相似。同时,在小鼠模型中分别采用了PD-L1阻断和Dac51小分子的治疗,发现其均能有效抑制肿瘤的体内生长,而联合PD-L1和FTO抑制剂能大幅提升治疗效果。此外,小鼠经治疗并清除肿瘤后,再次注射肿瘤细胞发现,肿瘤的生长受到了极大抑制,暗示了Dac51治疗后可能形成了针对肿瘤的免疫监视效应。进一步,研究者利用病人肿瘤样本建立的类器官模型中也发现,Dac51处理能有效地增强T细胞的抗肿瘤免疫应答,提示了Dac51在临床应用上的可能性。
综上,本研究首次报导了FTO在实体瘤中,通过调控调控RNA m6A修饰,上调肿瘤糖酵解代谢并抑制CD8+ T细胞激活的免疫逃逸新机制。研究者提出,m6A去甲基化酶FTO可作为免疫治疗的有效靶点,对RNA修饰进行干预将有望成为免疫治疗的新策略。
原文检索:Tumors exploit FTO-mediated regulation of glycolytic metabolism to evade immune surveillance
03
Science子刊丨我国科学家开发出比CAR-T细胞疗法更有效摧毁实体瘤的STAR-T细胞疗法

当前的嵌合抗原受体(CAR)T细胞(CAR-T)疗法主要用于破坏血液中的癌症。从患者的血液中分离出T细胞,并在实验室里进行基因改造使之表达CAR。这些经过特殊改变的T细胞(CAR-T细胞)在实验室中大量增殖。它们表面上表达的受体CAR是至关重要的,因为它与患者癌细胞表面上的一种特定蛋白结合,从而摧毁癌症。
一旦装备了受体CAR,CAR-T细胞会被重新注入患者体内,成为一个强大的战斗单位,数量达数百万个细胞。一些医生将这些特殊武装的T细胞称为“活的药物”,因为它们可以全天候地抗击癌症。还有人认为CAR-T细胞疗法是细胞疗法、基因疗法和免疫疗法合而为一。
无论如何定义这种疗法,CAR-T细胞疗法已经成为治疗B细胞淋巴瘤和某些形式的白血病的一种突破性形式。儿童患者一直是最大的受益者之一,因为与成人患者相比,该疗法在年轻人中特别成功。两种CAR-T细胞产品已经被美国食品药品管理局(FDA)批准上市。Kymriah(tisaglenlecleucel)是诺华公司的一种CAR-T细胞产品,于2017年8月获得批准上市,随后Yescarta(axicabtagene ciloleucel)也于同年10月获得批准。Yescarta由位于加州的Kite Pharmaceuticals公司开发。
然而,不论是儿童患者还是成人患者,实体瘤巧妙地避开了CAR-T细胞疗法阻止癌症的能力。脑部、乳腺、结肠、肺部和前列腺恶性肿瘤是这些CAR-T细胞无法渗透的。科学家们说,对于这些类型的癌症,CAR-T细胞并没有持续足够长的时间来摧毁肿瘤细胞。
在一项新的研究中,来自中国清华大学、清华大学-北京大学生命科学联合中心、首都医科大学和华夏英泰(北京)生物技术有限公司的研究人员合作开发了一种用于抗癌治疗的合成T细胞受体,以不同的方式增加T细胞的效力,有望对抗实体瘤。通过解决CAR-T疗法中的两个明显的弱点,该合成T细胞受体不仅具有寻找和摧毁实体瘤同时让健康组织不受影响的能力,而且还赋予这种抗癌武器强大的持久性来完成这项工作。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors。
更多解读:
这项新研究尽管仅在动物模型中开展,但是它是向针对实体瘤的新型CAR-T细胞疗法迈出的诱人一步,而这正是近年来全球竞赛的热门课题之一。这种新方法称为STAR-T细胞疗法,它与CAR-T细胞疗法的不同之处在于它的开发方式(使用合成受体)以及它如何利用强大的细胞信号转导活性来瞄准癌抗原。与CAR-T细胞一样,STAR-T细胞经激活后追捕肿瘤细胞并杀死癌症。
这些作者写道,CAR-T细胞疗法已在治疗B细胞恶性肿瘤方面显示出较高的反应率和持久的疾病控制;然而,在实体瘤方面,CAR-T细胞显示出有限的疗效,这部分上归因于CAR信号转导的内在缺陷。
这些作者没有修改CAR-T细胞疗法来产生STAR-T细胞疗法。相反,他们设计了一种合成T细胞受体(Synthetic T cell receptor)和一种抗原受体(Antigen Receptor),经过基因改造后表达这两种受体的T细胞(即STAR-T细胞)结合了CAR-T细胞的特征,但增加了内部的信号转导机制来模拟天然的T细胞。
在多种小鼠模型中,相比于CAR-T细胞,STAR-T细胞能够更好地控制多种实体瘤类型。在这些实验中,STAR-T细胞并没有像CAR-T细胞用于对付实体瘤时那样,变得功能衰竭。这些作者指出,CAR-T细胞的功能衰竭和无效是由于一种称为抗原非依赖性信号转导(tonic signaling)的现象,这是一种不协调的T细胞信号持续激活。当CAR-T细胞用于治疗实体瘤时还存在其他问题:它们会被肿瘤内部和周围的分子所抑制。
在这项新的研究中,STAR-T细胞通过迅速诱导患有胶质母细胞瘤以及肝癌和肺癌的试验小鼠体内的肿瘤消退,显示了对抗实体瘤细胞的强大活性。这些小鼠都没有显示出副作用的证据。STAR介导强而灵敏的T细胞受体样信号转导,STAR-T细胞表现出比传统CAR-T细胞更少的功能失调和更好的增殖。此外,STAR-T细胞比CAR-T细胞显示出更高的抗原敏感性,这在临床使用中具有减少抗原丢失和诱发肿瘤复发风险的潜力。
当这些作者专注于小鼠模型中的实体瘤作为他们的STAR-T细胞研究的目标时,来自北京陆道培血液病研究院的研究团队正在开展一项涉及STAR-T细胞疗法的人体1期临床试验,以确定人们对STAR-T细胞的耐受性。
该临床研究没有分析STAR-T细胞治疗实体瘤的疗效,但测试了STAR-T细胞输注用于治疗复发性B细胞急性淋巴细胞白血病。陆道培博士及其团队称,这项临床试验是“首次人体研究,旨在确定STAR-T细胞的技术可行性、临床安全性和疗效”,它有可能比传统的CAR-T细胞更好地识别和靶向肿瘤细胞内抗原。此外,STAR-T细胞更容易构建,这对治疗实体瘤有很大希望。
原文检索:Chimeric STAR receptors using TCR machinery mediate robust responses against solid tumors
04
Nat Comm | 申有青团队揭示小分子药物助力癌症化疗-免疫联合治疗

近年来,癌症免疫治疗领域取得了许多重大进展,尤其是针对程序性死亡-1(PD-1)/程序性死亡配体1(PD-L1)的免疫检查点阻断疗法(ICB),已极大地改善了癌症的治疗效果。在临床上,PD-1/PD-L1抗体显著延长了许多癌症患者的生存期,包括黑色素瘤和非小细胞肺癌等。其机制在于,肿瘤细胞的PD-L1与细胞毒性T淋巴细胞上的PD-1结合,导致其功能紊乱,遏制其介导的免疫攻击。因此,使用抗体阻断PD-1/PD-L1的相互作用可恢复T淋巴细胞的正常功能。然而,受限于抗体较差的肿瘤穿透性以及高度免疫抑制的肿瘤微环境, ICB疗法在约40%的黑色素瘤和实体瘤中无效。
因此,科学家探索出了通过缓解免疫抑制微环境以提高PD-1/PD-L1抗体治疗预后的方法。例如,一些化疗药物(如DOX),可以诱导肿瘤细胞发生免疫原性死亡(ICD),释放损伤相关分子模式(DAMPs),促进肿瘤相关抗原转移到树突状细胞(DCs),从而激活DCs的成熟和T细胞及记忆T细胞在肿瘤组织中的浸润,将免疫抑制性的 "冷 "肿瘤变成免疫反应性的 "热 "肿瘤。
不同阶段的临床试验显示出化疗结合ICB免疫疗法的益处,在这种联合治疗中,低剂量或标准剂量的化疗大多用于避免化疗引起的骨髓抑制和对宿主免疫系统的损害。但如何在低剂量下有效地诱导ICD,特别是在耐药的癌细胞中,是实现有效化疗-免疫治疗的关键。
提高ICB免疫疗法疗效的另一个关键问题是提高PD-1/PD-L1的阻断效率,由于抗体的肿瘤穿透性差,其阻断效率通常受到限制。一个前瞻性的策略是使用小分子药物来下调PD-L1的表达。一些激酶抑制剂,特别是细胞周期蛋白依赖激酶5抑制剂,以及一些天然化合物如黄芩苷被证明可以减弱肿瘤PD-L1的表达,但它们的疗效即使在动物模型中也普遍较低。
2021年4月23日,浙江大学申有青教授团队在Nature Communications杂志上发表题为Co-delivery of IOX1 and doxorubicin for antibody-independent cancer chemo-immunotherapy 的研究论文,在基于小分子药物的癌症化疗-免疫疗法领域取得重要进展。团队成员发现了一种组蛋白去甲基化酶抑制剂,5-羧基-8-羟基喹啉(IOX1),它能够抑制癌细胞的组蛋白去甲基化酶JMJD1A,下调β-catenin,从而减少其下游的P糖蛋白(P-gp)和程序性死亡配体1(PD-L1)表达,与阿霉素(DOX)结合可以抑制多种肿瘤模型的生长。由于JMJD1A在多种肿瘤中过量表达,并通过表观遗传的方式激活β-catenin及其靶基因的转录从而促进癌细胞的进展和侵袭,IOX1为癌症治疗提供了有效的无抗体化疗-免疫治疗范例。
更多解读:
在本项研究中,研究人员发现了一种高效的免疫治疗小分子,5-羧基-8-羟基喹啉(IOX1),它与DOX结合可以减少各种肿瘤模型的生长(图1)。IOX1不仅有效地下调了肿瘤PD-L1的表达,还可以抑制癌细胞的多药耐药性,促进细胞内DOX的积累,大大增强DOX诱导的ICD。在小鼠模型中,IOX1与DOX脂质体的结合(IPLD)大大促进了T细胞的浸润和活性,并明显减少了肿瘤的免疫抑制因素,在多种荷瘤小鼠模型中均表现出优异的抗肿瘤活性,不仅能清除起始肿瘤大小为80 mm3的小肿瘤,也能清除起始肿瘤大小为350 mm3的大肿瘤,并产生长期的免疫记忆,对抗皮下和肺转移瘤的再侵袭。
综上所述,IOX1通过JMJD1A/β-catenin信号通路降低肿瘤细胞P-gp和PD-L1的表达,与临床药物DOX结合,具有出色的抗肿瘤活性,与PD-L1抗体相比,IOX1疗效高且结构简单。此外,由于JMJD1A仅在肿瘤细胞中选择性地过量表达,IOX1能够减少治疗过程中的系统性毒性风险,为癌症化疗-免疫治疗提供了新的思路。
原文检索:Co-delivery of IOX1 and doxorubicin for antibody-independent cancer chemo-immunotherapy
05
Sci Adv | 李华兵等发现m⁶A调控肿瘤免疫中的巨噬细胞激活

RNA结合蛋白(RNA binding proteins, RBPs)是基因表达的关键效应因子,其能够识别数百上千个转录本,形成广泛的调节网络,调控RNA代谢的多个方面,包括转录、剪接、修饰、细胞内运输、翻译和降解等,从而维持细胞稳态和应激反应。
2021年4月28日,来自上海交通大学医学院上海市免疫学研究所李华兵研究员等团队在Science Advances杂志在线发表了题为 Pooled CRISPR Screening Identifies m6A as a Positive Regulator of Macrophage Activation 的研究论文,该研究利用CRISPR-Cas9基因筛查系统对巨噬细胞中800多个RBPs进行了筛查,最终发现并揭示了m6A甲基化酶METTL3通过加速TLR信号通路抑制分子IRAKM的mRNA降解,促进巨噬细胞活化的新机制。
更多解读:
为了研究RNA代谢对巨噬细胞活化过程的调控作用,研究者首先利用CRISPR-Cas9技术,对参与调控巨噬细胞活化过程的关键RNA结合蛋白进行高通量筛选,发现m6A甲基化酶复合物中的关键基因(METTL3、METTL14、NUDT21和RBM15)显著富集在TNFa-Low的细胞群中,提示m6A是对巨噬细胞活化十分重要。RNA m6A修饰是分布最广泛,丰度最高的RNA化学修饰,其参与RNA代谢调控的各个方面,在免疫系统中的研究主要发现其影响包括造血干细胞分化发育(Immunity | 高义萌/李华兵等合作揭示m6A在天然免疫和造血发育中的重要作用)、T细胞稳态(Nature:中美合作首次发现m6A修饰调控T细胞稳态丨BioArt特别推荐)、Treg免疫抑制功能(李华兵组揭示m6A调控Treg细胞的抑制功能)、抗病毒免疫和DC成熟等过程。然而m6A修饰是否参与调控固有免疫细胞活化过程仍然还不清楚。
接下来,研究者发现在单核/巨噬细胞细胞系Raw264.7及原代巨噬细胞中敲除METTL3均可显著抑制LPS诱导的巨噬细胞活化及后续炎症因子的产生。鉴于巨噬细胞在抗感染和抗肿瘤中的重要作用,研究者对METTL3在体内巨噬细胞中的功能进行了进一步的研究,发现巨噬细胞特异性敲除METTL3的小鼠对沙门氏菌更加易感,抗肿瘤能力下降;敲除METTL3的肿瘤浸润巨噬细胞高表达M2型巨噬细胞相关marker,而M1型巨噬细胞相关marker显著下调,相应的肿瘤浸润T淋巴细胞高表达免疫抑制性受体PD-1。上述结果表明METTL3可通过调控巨噬细胞的活化促进其抗感染和抗肿瘤功能。
进一步的研究发现,敲除METTL3可导致TLR信号通路的负调控应激因子IRAKM显著上调,而对其他关键的接头蛋白的表达水平没有显著影响,而在METTL3缺陷的巨噬细胞中敲低IRAKM可恢复巨噬细胞炎症因子的表达。研究者利用MeRIP-seq发现,Irakm mRNA的3UTR上有显著的m6A峰,敲除METTL3后该m6A峰消失,证明Irakm是m6A的靶基因。RNA降解实验和荧光素酶报告基因实验表明,m6A主要通过影响Irakm mRNA的降解,调控TLR信号诱导的巨噬细胞活化。
综上,此项研究发现了m6A甲基化酶METTL3靶向并降解早期应激反应分子Irakm的mRNA,调控巨噬细胞活化进而影响其抗感染和肿瘤杀伤能力。
该研究是李华兵研究员团队继首次发现m6A在T细胞稳态、Treg免疫抑制功能和HSC发育的重要生物学功能之后,再次发现m6A在免疫系统中的重要生物学功能。
原文检索:Pooled CRISPR Screening Identifies m6A as a Positive Regulator of Macrophage Activation
06
Science亮点丨向华/李明团队揭示护卫CRISPR-Cas的全新毒素-抗毒素RNA系统

2020年10月,基于CRISPR-Cas9系统建立的基因组编辑技术获得了“2020年度诺贝尔化学奖”。实际上,这一革命性生物技术起源于科学家们对微生物中一种特殊的免疫系统(即CRISPR-Cas系统)的研究。CRISPR-Cas系统是在原核微生物(古菌和细菌)中广泛存在的抗病毒(噬菌体)免疫系统。宿主菌通过将入侵病毒的特定DNA序列插入到其CRISPR结构中,可形成对该病毒的永久性“记忆”。这些记忆性序列(称为spacer)可转录加工生成crRNA、指导CRISPR-Cas系统效应物(如Cas9或Cascade复合物)特异性识别和切割再次入侵的病毒,实现对该类病毒的适应性免疫。CRISPR-Cas系统丰富多样的功能组分和核酸靶向机制,为人类提供了迄今最高效的基因组编辑技术(如CRISPR-Cas9系统)和基因检测技术(如CRISPR-Cas13a系统),因此近十余年来一直是生命科学研究的前沿。
CRISPR-Cas系统在微生物基因组中稳定性维持是其抗病毒功能实现的关键基础。一方面,CRISPR-Cas系统具有自我免疫的风险,并可能阻碍有益外源基因的获取,因此可对宿主细胞造成适合度代价(fitness cost)而可能在进化过程中频繁丢失。另一方面,微生物宿主与其病毒的“军备竞赛”中,CRISPR-Cas系统也会成为病毒反攻(Anti-CRISPR)的目标而丧失功能。面对多重的进化压力和适应性挑战,CRISPR-Cas系统为何能在微生物中广泛存在(存在于约90%的古菌和40%细菌中)并发挥其功能?在微生物宿主基因组中是否存在一类保护CRISPR-Cas功能但至今尚未被揭示的“暗物质”?这是科学家长期关注而又未能充分认识的前沿科学问题。
2021年4月30日,Science以长文形式(Research Article)在线发表了中国科学院微生物研究所向华/李明团队的最新研究成果Toxin-antitoxin RNA pairs safeguard CRISPR-Cassystems。首次在自然界分布最广泛的I型CRISPR-Cas基因簇内部发现了一类特殊的RNA“暗物质”:一类前所未见的对其偶联的CRISPR-Cas系统具护卫功能的——对RNA的毒素-抗毒素(CreTA)系统。由于CRISPR-Cas系统可利用RNA抗毒素CreA控制RNA毒素CreT的表达,使宿主菌无法丢失其CRISPR-Cas系统(对其“上瘾”)。因为一旦CRISPR-Cas组分被破坏,就会诱导CreT毒素的表达,从而抑制甚或杀死该宿主菌,从而保护了CRISPR-Cas系统在细胞群体中的稳定存在。这一“成瘾”机制的发现为理解CRISPR-Cas系统的稳定性维持和广泛性分布提供了全新视角,同时该文还揭示了一大类前所未知、功能多样的小RNA(曾被称为基因组中的“暗物质”),开辟了一个全新的研究领域。
更多解读:
早在2014年,向华/李明团队即利用西班牙盐盒菌(Haloarcula hispanica)及其病毒在国际上建立了第一个I型CRISPR系统的高效适应模型,揭示了CRISPR系统对病毒高效适应需要引发的规律,并深入解析了“引发适应”过程精细的分子机制,包括Cascade与crRNA的可塑性。在这一研究过程中,他们发现了一个奇怪的现象: 4个成簇的编码 CRISPR效应复合物Cascade的基因(cas6-cas8-cas7-cas5)无法单独敲除,但可以作为整体一起敲除,从而推测这个基因簇内部可能隐藏了一个未知的“细胞成瘾”元件。
经过近7年的探索,他们最终在cas6与cas8之间一段仅311 bp的基因间区内发现了一类全新的小RNA毒素-抗毒素系统,分别命名为CreT(RNA毒素)和CreA(RNA抗毒素)。CreTA通过与CRISPR效应复合物4个编码基因的结构与功能的偶联,守护了CRISPR-Cas系统的稳定性。
主要创新性发现:
1、首次发现受Cascade蛋白控制的小RNA毒素
该团队首先通过敲除cas6和cas8基因间区的311 bp序列获得∆TA菌株,然后基于该菌株成功获得了Cascade各单基因缺失菌株。接着,他们利用携带这一段311 bp基因间区的质粒(pTA)转化各突变株,发现在Cascade基因缺失(∆cas5-8)或其单基因缺失(∆TA∆cas5/6/7/8)的菌株中,pTA均表现出细胞毒性(转化效率降低约4个数量级),而在Cascade基因完整表达的∆TA菌株中,pTA的细胞毒性则被完全抑制。上述系列实验表明,311 bp的基因间区产生了某种未知毒素,命名为Cascade抑制型毒素(Cascade-repressed Toxin),即CreT。
为确定CreT的具体序列,该团队通过截短实验发现CreT毒性来自于一段132bp的序列,其中有一个典型的启动子序列,可起始转录产生了一个78nt的小RNA。突变分析进一步表明,该启动子及小RNA内部一段茎环结构的突变均导致CreT毒性的消失,说明CreT是一种具有细胞毒性的小RNA分子。CreT 的诱导表达实验进一步证明了其抑菌(bacteriostatic)而非杀菌(bactericidal)活性。
2、解析了小分子RNA毒素CreT独特的抑菌机制
对CreTRNA的精细序列和结构分析表明,其5'端具有强效的翻译信号SD(Shine-Dalgarno)序列和AUG起始密码,紧接其后的是两个精氨酸稀有密码子AGA, 随后是终止密码子UGA和一个茎环结构。系列突变实验表明,上述关键序列和结构都是CreT毒性所必需。基于此,该团队推断了一个全新的分子回路,即CreT RNA借助强效的翻译起始信号定位在核糖体上,然后通过两个串联的稀有密码子AGA进一步劫持胞内稀有的精氨酸tRNAUCU,从而抑制了胞内其它重要蛋白的翻译合成和细胞生长。基于这一猜想,他们通过过表达tRNAUCU成功解除了CreT的细胞毒性,证实了这一全新的毒性机制,即CreT 是通过其RNA劫持胞内稀有的精氨酸tRNA发挥毒性,而非翻译产生含二精氨酸的小肽发挥作用,因此CreT是一类小RNA毒素。
3、发现CreA抗毒素——类似crRNA的小分子RNA
为揭示Cascade蛋白抑制CreT毒性的分子机制,该团队首先敲除了胞内唯一的CRISPR array结构,从而排除了CRISPR array来源的crRNA参与毒性抑制的可能性。对311bp基因间区的截短与突变实验表明,creT下游序列为毒性抑制所必需。精细的序列分析和Northern印迹等实验表明,creT下游有一段与CRISPRrepeat高度相似的序列,该序列及其下游序列可独立转录产生一个约90nt的前体RNA,并被Cas6加工为一个的成熟的小RNA。该小RNA约41nt,含有与crRNA一样的完整的5' handle序列(8 nt),特定的spacer序列(约33nt),但缺乏crRNA常见的3' handle,因此命名为“类crRNA抗毒素”(CrRNA-resembling Antitoxin),简称CreA。CreA作为crRNA类似分子,即可能联合Cascade蛋白对CreT毒素活性发挥抑制作用。
4、揭示CreA RNA联合Cascade发挥抗毒素活性的分子机制
该团队进一步揭示,与crRNA介导Cascade复合物识别外源靶序列一样,CreA介导Cascade精确识别creT启动子。CreA种子序列区(5' handle 后约11nt)与creT启动子完全匹配(除不参与碱基匹配的第6个核苷酸外),而其余大部分序列不匹配。对CreA的5' handle序列和种子序列区的突变、以及对保守PAM(protospacer adjacent motif)序列的突变,都将导致CreA对 creT启动子抑制活性的丧失,进一步证明CreA联合Cascade实现了对CreT的转录水平调控,从而在正常情况下可抑制CreT的表达及毒性。
特别需要指出的是,该团队早期实验已经揭示了crRNA的高度可塑性,其结构(如是否含有3' handle序列)及spacer与靶序列匹配长度的不同,可以指导Cascade对外源靶标DNA实现干扰或引发适应两种不同的生理效应。本研究进一步发现CreA与creT基因启动子序列之间的不完全匹配性指引了多亚基Cascade效应物结合并抑制毒素启动子的活性,从而实现对毒素基因的转录水平调控,这在国际上首次揭示了多亚基CRISPR效应物固有的基因调控生理功能。
5、揭示CreTA对CRISPR-Cas系统的护卫功能
通过研究在有无CreTA存在时,活跃的可移动元件IS(insertion element)对cascade基因的破坏行为,该团队进一步证实了CreTA作为一个极简的“成瘾”元件保护CRISPR-Cas系统的生理功能。当CreTA存在时,可以保证Cascade基因(cas6-cas8-cas7-cas5)不被可移动元件插入失活,而当CreTA丢失后,由于CRISPR-Cas系统固有的适合度代价,Cascade基因被IS元件频繁破坏。
6、揭示CreTA 同源或类似系统在不同微生物和不同CRISPR亚型中的普遍存在
该团队还通过深入挖掘现有的微生物基因组数据,并与美国NCBI生物信息领域知名专家Eugene V Koonin教授团队合作,进一步发现多种古菌/细菌的不同类型CRISPR-Cas系统中潜藏着CreTA类似物,暗示CRISPR-Cas可能普遍利用CRISPR效应物固有的基因调控功能(如抑制一个毒性RNA的转录)对冲其适合度代价。这一全新机制的发现从新的视角解释了CRISPR-Cas在微生物中的广泛分布。
值得特别强调的是,已知的毒素-抗毒素(TA)系统都编码一个毒素蛋白,而该工作发现的CreTA利用了一个极简的小RNA(CreT)作为毒素组分,而且其抗毒素(CreA)也是一个小RNA,并依赖于Cascade复合物发挥功能,因此,CreTA或可定义一个新的TA分类单元。更重要的是,这类系统全新的分子机制为基因工程和基因编辑等应用提供了重要的元件和启示,例如,该团队一方面已利用CreT开发了可在细菌和古菌中通用的极简的反向筛选标记,为基因工程提供了新元件;另一方面基于CreA调控creT转录的分子回路开发了同步实现基因编辑和基因调控的新技术(均已申请专利)。
该发现不仅在CRISPR-Cas及其偶联系统生物学研究中具有重要意义,而且为研究原核微生物“非编码RNA暗物质世界”敞开了一道门。该论文指出在不同古菌和细菌不同类型的 CRISPR-Cas系统中发现的CreTA类似物在序列上多样性丰富,可能蕴藏了大量未知的毒性机制和功能元件。因此,这类丰富多样的“暗物质”的深入发掘将进一步推动生物技术的发展,包括对未来小RNA药物的研制或将具有启发意义。
原文检索:Toxin-antitoxin RNA pairs safeguard CRISPR-Cassystems
07
Science | 赵素文/张雁/赵惠民合作团队揭示Z-基因组生物合成通路

在与细菌无休止的攻防大战中,噬菌体的DNA经常通过修饰来逃避宿主内切酶的攻击。2-氨基腺嘌呤(Z)就是其中一个例子,它是一种独特的碱基修饰,在噬藻体S-2L(cyanophage S-2L)的 DNA中完全取代了腺嘌呤(A),与胸腺嘧啶(T)形成具有三根氢键的碱基配对(图1)。自1977年被苏联科学家Ivan Khudyakov发现以来,噬藻体S-2L一直是唯一已知具有Z-基因组的物种。噬藻体的发现者曾推测,该物种中应该存在一个多酶系统,负责dZTP的生物合成及其选择性地被整合入基因组。
然而,44年来,Z-基因组的生物合成通路、存在的广泛性、及其重要性一直是未解之谜。这主要是因为它的基因组长时间以来一直未被测序。
本世纪初,法国巴斯德研究所一个研究团队把噬藻体S-2L的基因组测序、序列申请专利并上传到NCBI GenBank数据库中。遗憾的是,这次测序在长达十多年的时间里并没有帮助阐明Z-基因组的生物合成通路。现在看来,这是由于这次测序质量较低,序列中存在着一些突变及增删错误,致命的是推测参与Z-基因组生物合成通路的关键基因purZ就在两个位点出现了测序错误,导致其同源重组表达后没有任何功能。
随着测序技术的不断进步,公共数据库中的序列爆炸性增长,自2016年起,GenBank数据库中不断出现来自其它噬菌体的与PurZ高度同源的蛋白,为破解Z-基因组的生物合成通路奠定了基础。
4月28日,Science杂志在线发表上海科技大学的赵素文研究员,天津大学的张雁教授和A*STAR/UIUC的赵惠民教授合作团队的研究成果:A widespread pathway for substitution of adenine by diaminopurine in phage genomes,揭示了Z-基因组生物合成通路。
更多解读:
在本研究中,合作团队首先通过生物信息学分析对GenBank数据库中的数十个PurZ蛋白的序列进行了分析,发现它们和其远源同源蛋白PurA(催化AMP合成通路中的第一步,底物是IMP)相比,在活性口袋具有几处明显的区别:(1)PurA中是D13在PurZ中是S23,这个变化使得PurZ的活性口袋在这个位置可以容纳的底物比PurA要略大一些;(2)在决定底物是核糖核苷或是脱氧核糖核苷的残基位点,在PurA中是G298和K303,而在PurZ中是T273和L278。这些活性口袋内残基的变化使得PurZ可以用dGMP为底物,催化dZMP合成通路中的第一步。dZMP经过宿主激酶的处理即可生成DNA聚合酶所需的dZTP。
接下来的问题是,在dZTP和dATP都存在的情况下,噬菌体编码的DNA聚合酶如何保证选择性地使用dZTP?合作团队在分析purZ的基因组邻近区时发现,purZ基因附近有两个磷酸酶在多个噬菌体中都存在。
其中一个磷酸酶含有HD结构域,与其关系最近的有结构的同源物是磷酸水解酶OxsA(PDB ID:5TK7,序列相同度为18%)。OxsA具有水解dATP的功能,因此合作团队预测该酶的功能是dATP水解酶。该预测得到了酶活实验验证,因此该酶被重命名为dATPase。dATPase可以水解dATP/dADP/dAMP,切断的是与脱氧核糖C5’直接相连的磷酸酯键,产物分别是dA和三磷酸/焦磷酸/磷酸。dATPase对其他dNTP及NTP均无作用。合作团队认为,dATPase的作用,是降低dNTP池中的dATP及其前体的浓度,从而使得热力学上和T配对更稳定的Z碱基所对应的核苷dZTP可以被噬菌体的DNA聚合酶选择性使用(注:合作团队使用Q5聚合酶验证过,在dZTP:dATP = 1:1时,PCR产物中只有Z而没有A)。另外一个磷酸酶属于DUF550家族,它是一个焦磷酸水解酶,可以水解dATP/dGTP为dAMP/dGMP和焦磷酸。它的一个作用是进一步降低dATP的浓度,另一个作用是增加dGMP的浓度,而dGMP是PurZ的底物。
综上,合作团队发现了一个多酶系统,由PurZ、dATPase 、DUF550和DNA聚合酶这几个来自噬菌体的酶和两个来自宿主的PurB和GK共同组成,负责dZTP的生物合成及其被选择性地整合入噬菌体基因组(图2)。
作团队发现近百个分布在全球各地的噬菌体中都含有该通路的关键基因purZ,并因此推断这些噬菌体也都具有Z-基因组。合作团队选取了其中一个在上海被分离的噬菌体Acinetobacter phage SH-Ab 15497来进行多角度的在体实验验证,所使用实验手段包括液相色谱-紫外联用,液质联用,和纳米孔测序。这些实验都验证了该噬菌体具有Z-基因组,这是第二个被实验验证的具有Z-基因组的噬菌体,而噬藻体 S-2L是此前唯一已知具有Z-基因组的物种。这证明了Z-基因组噬菌体在大自然中存在的广泛性。
合作团队进一步验证了Z-基因组的生物学意义。通过使用来自宿主的限制性核酸内切酶和一系列其他内切酶对Acinetobacter phage SH-Ab 15497的Z-基因组的切割实验,合作团队确认,识别位点中含有A的限制性核酸内切酶无法切割Acinetobacter phage SH-Ab 15497的Z-基因组。因此,Z-基因组的生物学意义是使得噬菌体可以逃避宿主内切酶的剪切,从而赋予噬菌体演化上的优势。
综上,合作团队对Z-基因组合成通路、存在的广泛性、及生物学意义的研究,使得大规模合成Z-DNA从而展开各种应用研究如噬菌体疗法、合成生物学和DNA存储等成为可能。
原文检索:A widespread pathway for substitution of adenine by diaminopurine in phage genomes
08
苏晓磊团队发现磷脂酶PLCγ1促进T细胞信号通路相分离

在免疫细胞被激活的过程中,细胞表面多种受体(包括TCR, BCR, FCγ, CAR, CD28, PD1等)会进行自组装,形成从几十纳米到微米级别的微簇 (microcluster)。这些微簇富集多种信号分子,没有固定组成,处于动态变化中,它们的形成机制以及功能是免疫信号转导领域的一个经典的问题(Protein & Cell | 免疫信号通路中的生物大分子高聚体:超分子复合物与相分离)。
2021年4月30日,耶鲁大学苏晓磊教授团队近日在Journal of Cell Biology上发表题为PLCγ1 promotes phase separation of T cell signaling components 的文章,揭示了磷脂酶PLCγ1的一项不依赖于其酶活性的促进T细胞信号分子相分离的新功能。
更多解读:
当T细胞受体被pMHC激活后,引起下游一系列磷酸化反应。LAT是T细胞信号转导中的关键架构蛋白。之前的研究发现磷酸化的LAT可以相分离从而促进T细胞活化。但是LAT相分离的调控机理不甚明了。磷脂酶PLCγ1是LAT下游的一个蛋白。LAT被磷酸化后,招募PLCγ1到细胞膜。PLCγ1水解PIP2,形成IP3和DAG,分别激活钙信号和PKC通路, 这些是T细胞活化过程中不可或缺的步骤。本文作者发现,PLCγ1能够通过其所含的两个SH2 domain交联 LAT, 稳定LAT微簇的结构。同时PLCγ1还保护LAT不被磷酸酶CD45去磷酸化,进一步促进LAT相分离和下游MAPK和actin信号激活。
有趣的是,PLCγ1仅在一定浓度范围内促进LAT相分离。过高浓度的PLCγ1并不促进相分离。
基于“coarse-grained”模型,作者对这一过程就行了计算机模拟。结果显示过高浓度的PLCγ1使得微簇内的终端节点增加,从而不利于微簇生长。
本项研究拓展了PLCγ1在T细胞信号转导中的功能:PLCγ1不仅能通过水解PIP2激活自身下游的钙信号,还可以通过调节上游的LAT相分离,影响ERK和actin等其他信号通路。
PLCγ1不仅是TCR信号中的关键分子,其在FcR, EGFR, FGFR, HER2等众多受体信号通路中都承担了重要角色。PLCγ1在其他信号通路中是否也有类似促进相分离的作用是今后研究中有待解决的一个问题。
原文检索:PLCγ1 promotes phase separation of T cell signaling components
09
Nat Genetics | 次要剪接体突变在白血病中的功能研究

RNA剪接(RNA splincing)是生物体极为重要的生命活动,指从pre-mRNA中除去内含子,并将外显子连接起来形成成熟mRNA的过程。大部分真核生物有两套截然不同的pre-mRNA剪接机器:主要剪接体(major spliceosome)和次要剪接体(Science | 施一公团队首次报道激活状态人源次要剪接体结构)(minor spliceosome)。超过99%的内含子属于主要内含子(也称为U2型内含子),可被含U2 snRNA的主要剪接体去除;少数次要内含子(U12型),仅有700-800个基因,则由次要剪接体去除。
次要内含子在不同真核生物中的超高保守性表明他们具有重要的调控作用。
已有少量研究阐述了次要内含子可能的功能。比如,次要内含子的剪接效率远低于主要内含子,这说明机体可能通过调控次要内含子的剪接效率影响基因的表达。但是,目前关于次要内含子在生物表型调控中的功能还鲜有报导。
2021年4月12日,来自美国华盛顿大学和纪念斯隆-凯特琳癌症中心的Robert K. Bradley和Omar Abdel-Wahab在Nature Genetics发表题为 Minor intron retention drives clonal hematopoietic disorders and diverse cancer predisposition 的研究,该研究阐明了次要剪接体成员ZRSR2基因的突变通过调控LZTR1基因中一个次要内含子的剪接,促进恶性造血疾病发生发展的机制。
更多解读:
正确的RNA剪接是基因正常表达所必须的。也因此,RNA剪接体的突变与疾病密切相关。骨髓增生异常综合征(myelodysplastic syndromes, MDS)是一种克隆性血液疾病,表现为髓系细胞的分化和发育异常,并具有极高的向急性髓系白血病(acute myeloid leukemia,AML)转化的风险。超过50%的MDS患者都携带有一个RNA剪接因子相关的突变,这些突变在AML中也很常见。其中,白血病中最常见的剪接因子突变基中在四个基因上,分别是:SF3B1,SRSF2, U2AF1 和ZRSR2。其中,前三个属于功能改变型突变(change-of-function),而由X染色体编码的ZRSR2则是功能缺失突变(loss-of function)。同时,ZRSR2也是这四个白血病常见突变基因中唯一一个次要剪接体的成员。但是ZRSR2在白血病中的具体功能尚不清楚。
为研究ZRSR2的功能,研究者构建了时间和组织特异性的Zrsr2敲除小鼠,并发现Zrsr2在造血系统的缺失能够极大的提高造血细胞的自我更新能力。这也与MDS和AML中ZRSR2的突变现象相符。对是否携带ZRSR2突变的MDS样品测序显示,ZRSR2突变造成了U12型内含子的识别异常,超过1/3的U12型内含子被异常的保留在成熟mRNA中,而由主要剪接体负责的U2型内含子则不受ZRSR2突变的影响。这说明ZRSR2通过影响U12型内含子的剪接调控造血细胞的表型。
进一步,研究者分析ZRSR2调控的具体下游基因。首先要回答的问题是为什么仅1/3的U12型内含子受ZRSR2的调控。通过序列分析,研究者发现对ZRSR2缺失敏感的U12型内含子,具有更靠近3’端的剪接分支位点。接下来,研究者在3个细胞系中利用CRISPR对ZRSR2的601个下游基因进行功能筛选。意外的是,仅有一个基因(LZTR1)的缺失可同时影响3个细胞系的表型。LZTR1基因编码cullin-3衔接子,可调节泛素介导的RAS相关GTPase的沉默。可变剪接分析显示,在ZRSR2缺失的细胞中,LZTR1基因的U12型内含子下剪接效率明显降低,而该内含子的保留影响LZTR1的正常表达。
有趣的是,在神经胶质瘤等疾病中也有LZTR1基因突变,而这些突变发生在非编码的U12型内含子区域。研究者发现这些突变也会造成U12型内含子的剪接异常并导致LZTR1的失调表达。这提示除了次要剪接体相关基因的突变,U12型内含子突变在疾病中也有重要功能。
总的来说,该研究揭示了次要剪接体在造血细胞自我更新能力中的功能,阐述了ZRSR2突变和LZTR2的异常剪接参与白血病进程的具体机制,为进一步研究次要剪接体的功能提供了理论基础。
原文检索:Minor intron retention drives clonal hematopoietic disorders and diverse cancer predisposition
10
Nat Methods 新工具| 杨辉团队发现和应用新Cas13X/Y系统进行高效的RNA编辑

CRISPR/Cas13是一类RNA介导的靶向RNA切割的系统,它被广泛地应用于RNA敲低(专家点评丨杨辉/黄鹏羽合作组首次证实Cas13d系统在成体动物体内具有靶向沉默RNA的活性)、RNA单碱基编辑、RNA定点修饰、RNA活细胞示踪以及核酸检测领域。相比于传统的RNA干扰技术,Cas13系统具有更高的敲低效率和特异性;而且,相比于Cas9介导的DNA编辑技术,Cas13不会对基因组造成永久性改变,甚至可以通过药物来调控RNA编辑,使其具有可逆性,因此在疾病治疗上具有比较独特的优势。
2015年,美国国家生物技术信息中心的进化生物学家Eugene Koonin实验室和美国Broad研究所的张锋团队合作,利用计算生物学方法在微生物宏基因组数据库中发现了Cas13a(c2c2),Cas13b(c2c6)和Cas13c(c2c7)三种系统,并后续证明了这些系统在哺乳动物细胞中可以对靶RNA进行高效地敲低。张锋团队进一步对Cas13和RNA脱氨酶ADAR2进行改造,将其应用于哺乳动物的RNA单碱基编辑。2018年,美国Salk研究所的Patrick D Hsu和Arbor Biotechnologies公司的David A Scott从张锋实验室获得博士学位之后,各自致力于新的Cas13系统的开发。继Eugene Koonin和张锋发现Cas13a/b/c不久,他们分别在Cell和Molecular Cell上同时报道了Cas13d系统,相对于之前的系统,Cas13d蛋白减少了100到200个氨基酸。其中, Patrick D Hsu实验室发现的RfxCas13d展现了最佳的敲低效率,加上体积小的优势使得它广受领域内研究者的追捧。虽然RfxCas13d只有967个氨基酸,但是整个系统已接近单个AAV的装载极限了,而基于Cas13d的RNA单碱基编辑工具则更难用单个腺相关病毒 (Adeno-associated virus, AAV) 载体进行递送,因此开发更小的高效的RNA编辑工具对临床转化具有重要意义。
2021年 5 月2日,中科院脑智中心(中科院神经所)杨辉团队在Nature Methods上在线发表了题为 Programmable RNA editing with compact CRISPR–Cas13 systems from uncultivated microbes 的研究论文。该研究通过对微生物大规模宏基因组数据进行计算分析发现两类新的CRISPR/Cas13系统,通过功能实验和工程化改造开发了一套高效率和高特异性的RNA编辑工具,该工具对开发基于RNA编辑的基因治疗手段具有重要的促进作用。
更多解读:
最近报道的Cas13系统都是从可培养的微生物基因组数据中挖掘的,然而自然界中90%的微生物都是不可培养的,因此,杨辉团队这次把目标聚焦在挖掘未获培养的自然微生物宏基因组数据。该研究通过精巧的计算生物学算法和实验设计,鉴定到了两个新的Cas13家族,并命名为Cas13X和Cas13Y,其中,Cas13X.1蛋白比常用的RfxCas13d蛋白还要小将近200个氨基酸,为目前最小的Cas13蛋白。通过对大量内源基因位点进行RNA敲低实验,Cas13X.1展现了与RfxCas13d同样的高活性和高特异性。为了进一步研究Cas13X.1在抗RNA病毒方面的应用潜力,团队成员分别对H1N1病毒和过表达的部分新冠病毒基因组上多个位点进行靶向切割,发现Cas13X.1在体外展现了良好的病毒抑制效果。最后,杨辉团队将突变的dCas13X.1与ADAR2dd进行融合,并做了一系列蛋白截短改造,开发了一种迷你型的RNA单碱基编辑工具,通过与之前报道的RNA单碱基编辑系统进行比较, 发现基于迷你型Cas13X.1蛋白的RNA单碱基编辑系统(miniCas13X-ADAR2dd)可以对靶RNA进行高效的A到I和C到U的编辑。同时,miniCas13X-ADAR2dd比REPAIR和RESCUE系统小将近900aa,可以包装到一个AAV里面。此外,全转录组分析显示,迷你碱基编辑器脱靶活性极低,是一项高保真的碱基编辑技术。值得一提的是,目前Cas13系统应用于临床最大的障碍是Cas13蛋白本身的旁切活性 (collateral activity, 靶RNA激活的非靶标RNA切割活性)。已有证据表明Cas13d的旁切活性会对动物细胞和个体产生一定毒副作用。虽然Cas13X.1在体外切割实验中显示了比Cas13a和Cas13d更低的旁切活性,但是将来对Cas13X.1的进一步改进,以及体内的长期安全性评价,对于临床上安全应用Cas13至关重要。
此工作成功地从未获培养微生物宏基因组数据中鉴定到了两个新的Cas13系统,极大地丰富了Cas13家族的多样性。而且通过大量实验证明了Cas13X.1在RNA编辑方面具有非常大的应用潜力,小的尺寸很好的解决了Cas13体内递送的问题,有望在未来成为一种高效和安全的RNA治疗药物,为疾病 (尤其是罕见病) 基因治疗提供了更多的选择。
原文检索:Programmable RNA editing with compact CRISPR–Cas13 systems from uncultivated microbes
11
Blood | 利用 iPS 细胞体外造血细胞分化体系研究由甲醛代谢相关酶基因缺陷所导致的遗传性再生障碍性贫血

遗传性再生障碍性贫血是儿科常见的疑难病症,多数患者病情最终发展为白血病,其病理机制至今尚未阐明。在先前的研究中,英国剑桥大学 KJ Patel 团队和日本京都大学高田穣团队共同合作于2020年11月3日在 Mol Cell 杂志上报道了一种新型再生不良性贫血症,患者同时出现了 ALDH2 (Aldehyde Dehydrogenase 2,乙醛脱氢酶2) 和 ADH5 (Alcohol Dehydrogenase 5,乙醇脱氢酶5) 的变异,导致造血分化的过程中产生的甲醛不能被正常分解、DNA 损伤累积,继而诱导再生障碍性贫血的发生,并最终发展成为白血病。据了解,作者将这类「ADH5/ALDH2功能缺陷症」命名为 “醛降解缺陷综合征”【Aldehyde Degradation Deficiency (ADD) Syndrome】。近日,日本京都大学高田穣团队在 Blood 期刊发表了题为 Analysis of disease model iPSCs derived from patients with a novel Fanconi anemia–like IBMFS ADH5/ALDH2 deficiency 的研究长文。通过CRISPR/Cas9 基因编辑技术以及体外造血细胞分化等技术手段揭示了 ADH5/ALDH2 如何在人体造血干细胞分化过程中通过代谢甲醛来避免造血干细胞受损。
更多解读:
作者首先发现,向携带 ALDH2 基因变异的淋巴细胞(来源于正常人体)中加入 ADH5 抑制剂后,姐妹染色单体互换 (sister chromatid exchanges ,SCEs) 显著升高。有趣的是,在 HAP1 细胞系 (来源于慢性白血病患者) 中即使敲除 ADH5/ALDH2基因,也不会对细胞造成任何影响,但是仅加入 0.5μM 的甲醛即可使 SCE 显著升高,而SCE 升高即代表了 DNA 损伤的增加。同时,在细胞毒性测试实验中,细胞中ALHD2 的单独敲除并不会因甲醛的毒性而导致死亡率升高,但是在ADH5 缺损的情况下,ALDH2 对于甲醛的代谢非常重要,这一发现揭示了ADH5 和ALDH2在甲醛代谢过程中的协同作用。
此外,作者通过细胞重编程技术将患者的皮肤细胞改造为诱导性多能干细胞(iPSCs),并通过CRISPR/Cas9技术将缺损的 ADH5基因回补到患者iPS细胞中,该回补系统可以通过 doxycycline (DOX) 诱导 ADH5 的表达。同时,作者制作了基于201B7-iPS细胞系的ADH5/ ALDH2敲除细胞作为对照。体外造血细胞分化实验结果显示,ADH5 或 ALDH2基因的单独敲除对造血 colony 的形成影响很小,但是ADH5/ALDH2 的双敲除导致造血干细胞集落(colony)几乎无法生存。同时携带ADH5和ALDH2基因缺陷的患者,其iPS细胞几乎无法形成完整的造血干细胞集落(colony),并且在造血祖细胞阶段DNA损伤程度较高,但ADH5 的表达在很大程度上挽救了这种现象。此外,新型 ALDH2 激活剂C1可以在一定程度上促进造血分化缓解症状。进一步的研究发现,ADH5/ALDH2的缺损阻碍了CD34+细胞 (造血干细胞) 向CD45+ (成熟血液细胞) 的分化。在成熟血液细胞的分化过程中,ADH5 或 ALDH2 单敲除的情况下均可观察到DNA损伤的累积,证明了在造血分化过程中甲醛的持续产生。
该研究证实了ADH5/ALDH2的缺损可以导致造血分化中大量的甲醛囤积,进而造成DNA过量损伤,且损伤程度超出了DNA的修复能力。结合其他团队的研究,这些发现或可解释范可尼贫血的发病机制。ALDH2是乙醛(酒精的次代谢产物)代谢过程中非常重要的代谢酶,该基因的突变会导致乙醛的分解能力骤减,常见的特征为喝完酒后面部发红。中国约有 ~40%、日本约有 ~50% 的人持有 ALDH2 基因的变异,东亚地区人口中约~40%的人持有 ALDH2 变异。此次的研究表明了ALDH2同时具有较强的甲醛分解能力。本研究结果表明,常见的甲醛代谢基因突变可能是遗传性血液疾病的重要成因。此外,两个醛类代谢酶基因(ADH5/ALDH2)的缺损将导致再生障碍性贫血,该研究成果或可为白血病的治疗带来新的突破。
原文检索:Analysis of disease model iPSCs derived from patients with a novel Fanconi anemia–like IBMFS ADH5/ALDH2 deficiency
12
Nature | 诺奖得主最新发现,生物体竟会通过挤压来清除癌细胞,为癌症治疗带来新思路

对于所有动物而言,清除某些细胞是胚胎发育中所必须的,活细胞在成熟组织中也会自然脱落。例如,肠壁每隔几天就会完全焕新一次。
生物体清除不需要的细胞的一种方式是通过称为细胞挤压的过程,该过程将细胞从组织层中挤出,而不会破坏留下的细胞层。 这一过程之前就已经被观察到,但生物体如何触发这一过程,仍然是个谜。
2021年5月5日,诺奖得主、麻省理工学院 Robert Horvitz 教授团队在 Nature 期刊发表了题为:Replication stress promotes cell elimination by extrusion 的研究论文。
研究人员在线虫中发现,当细胞分裂过程中细胞无法复制其DNA时,就会触发细胞挤压的过程。并进一步表明,哺乳动物细胞可以驱动相同的过程。
细胞挤压是从海绵到昆虫再到人类等生物体都在使用的细胞清除机制,这种机制可能是生物体清除癌细胞或癌前细胞的一种方式,为癌症治疗带来一种全新的思路。
更多解读:
细胞凋亡
在19世纪80年代,Robert Horvitz 教授就开始了对一种名为凋亡(apoptosis)的程序性细胞死亡进行研究,生物体通过凋亡来清除自己不再需要的细胞。
Robert Horvitz 教授使用秀丽杆线虫线虫(C. elegans)进行研究,这种仅有1毫米长的透明小虫是一种著名的模式动物,它的每个细胞的发育谱系都是已知的,并且每次胚胎发育都遵循相同的模式。在整个发育过程中产生了1090个细胞,并通过凋亡杀死其中的131个细胞,最终形成一个仅包含959个细胞的个体。
2002年,Robert Horvitz、Sydney Brenner、John Sulston 三人因发现器官发育和细胞程序性死亡的遗传调控机理而荣获当年的诺贝尔生理学或医学奖。
后来,Robert Horvitz 教授团队发现,如果线虫经过基因突变后无法通过凋亡来清除细胞,那么这131个细胞中的少数将通过细胞挤压清除,这种细胞挤压似乎可以作为细胞凋亡的备用机制。
但是,如何触发这一细胞挤压过程仍然是一个谜。
陷入细胞周期
为了揭开这个谜底,研究团队进行了大规模基因筛选,共筛选了超过11000个秀丽隐杆线虫基因。研究团队逐个敲低了无法执行细胞凋亡的线虫中的每个基因的表达,通过这种筛选,能够鉴定出对于发育过程中开启细胞挤压至关重要的基因。
令人惊讶的是,许多在细胞挤压过程中必不可少的基因同时参与细胞分裂周期。这些基因在细胞周期的最初阶段活跃,启动细胞分裂周期并复制细胞DNA。
进一步的实验表明,最终被挤出去的细胞确实开始进入细胞周期并开始复制其DNA。但是,它们似乎在此阶段被卡住,无法继续分裂,导致它们被其他细胞挤出。
大多数最终被挤出的细胞都异常小,它们是由不平等的细胞分裂产生的,导致一个大的子细胞和一个小得多的子细胞。研究团队发现,如果干扰了控制该过程的基因,从而使两个子细胞大小接近,那么原本应该被挤出的细胞就能够成功完成细胞周期,而不会被挤出。
研究团队还发现,这种异常小的细胞无法完成细胞周期的原因是复制DNA时所需的蛋白质和DNA组分。在其他关键蛋白质中,这些细胞可能没有足够的LRR-1酶,这对DNA复制至关重要。
当DNA复制停止时,负责检测复制压力的蛋白质会使CDK1蛋白失活,从而迅速停止细胞分裂。此外,CDK1还有一个重要功能,就是控制细胞粘附,因此研究团队推测,当CDK1蛋白失活时,细胞会失去粘性并脱落,从而导致被挤出。
癌症保护
接下来,研究团队开始研究哺乳动物细胞是否可能有相同的细胞挤压。结果发现,在哺乳动物中,细胞挤压在替换肠、肺和其他器官的内壁细胞中起着重要作用。
研究团队使用一种叫做羟基脲的化学物质来诱导培养皿中生长的犬肾细胞的DNA复制压力,结果发现,这种处理使细胞挤出速率提高了三倍。
该研究还发现,在哺乳动物细胞中,众所周知的癌症抑制因子p53参与启动经历复制压力的细胞的挤出。这表明p53除了具有已知的癌症保护作用外,还可以通过挤出癌变细胞或癌前细胞来起到保护作用。
复制压力是癌前细胞或癌变细胞的特征之一,这些发现表明,挤出受到复制压力的细胞可能是一种抑癌机制。
从低等的海绵,到高等的哺乳动物,都可以观察到存在细胞挤压,而且,这种通过细胞挤压来清除细胞的机制只依赖细胞周期,不需要像细胞凋亡那样需要专门的机制来执行。因此研究团队推测它可能是一种非常早期的细胞清除形式,后来被涉及细胞凋亡的程序性细胞死亡所取代。
总的来说,该研究发现了当细胞分裂过程中细胞无法复制其DNA时,就会触发细胞挤压的过程,并证实了这一机制在动物中广泛存在,这种机制可能是生物体清除癌细胞或癌前细胞的一种原始方式,为癌症治疗带来一种全新的思路。
原文检索:Replication stress promotes cell elimination by extrusion
其他最新文章推荐
3D iPSC modeling of the retinal-pigment-epithelium-choriocapillaris complex identifies factors involved in the pathology of macular degeneration

Organelle degradation in the lens by PLAAT phospholipases

Mitochondrial NADP(H) generation is essential for proline biosynthesis

Psychedelic-Inspired Drug Discovery Using an Engineered Biosensor

Structural basis of GABAB receptor-Gi protein coupling

Single cell regulatory landscape of the mouse kidney highlights cellular differentiation programs and disease targets

文章来源:公开信息搜集
