关注生命科学领域突破进展,聚焦热点政策,观澜创新治疗产品行业动态,耕耘于分秒,收获于细微,做乘风破浪的生物医药人!

01
国家药监局药审中心关于公开征求《克罗恩病治疗药物临床试验技术指导原则》意见的通知

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=754b58c573348fc3
02
国家药监局药审中心关于公开征求《以临床价值为导向的抗肿瘤药物临床研发指导原则》意见的通知
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=192f27a82e3ccafe
03
国家药监局药审中心关于公开征求《化学药品吸入液体制剂药学研究技术要求(征求意见稿)》意见的通知
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=9d38319f23ccd131
04
国家药监局药审中心关于公开征求《化学药品创新药上市申请前会议药学共性问题相关技术要求(征求意见稿)》意见的通知

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=b35d462635c5dc71
01
有机砷抗癌疗法在日本提交新药申请,治疗淋巴瘤
近日,日本Solasia Pharma公司宣布,已经向日本厚生劳动省(MHLW)提交了其在研药物darinaparsin的新药申请(NDA),用于治疗复发/难治性外周T细胞淋巴瘤(PTCL)。这是darinaparsin在全球范围内的首个新药申请。本次新药申请基于在亚洲进行的2期临床试验的积极结果。Solasia计划在即将举行的国际学术会议上公布试验结果。此外,darinaparsin已在美国和欧盟获得治疗PTCL的孤儿药资格。
02
同种异体“隐形”CD19 CAR-T细胞药物完成1期试验首例患者给药
7月1日,一家临床阶段生物技术公司Precision BioSciences宣布该公司的药物PBCAR19B的1期临床试验已经完成首例患者给药。
03
靶向CCR4 「莫格利珠单抗」在中国递交上市申请
7月2日,CDE公示,协和麒麟已递交莫格利珠单抗注射液的上市申请,并获得受理。公开资料显示,莫格利珠单抗(mogamulizumab)是一款CCR4靶向抗体,曾获FDA突破性疗法认定和优先审评资格,并已在美国获批上市,用于治疗蕈样真菌病或塞扎里综合症成年患者。
04
罗氏PD-1/LAG-3双特异性抗体在中国申报临床
CDE公示显示,罗氏正在研发的RO7247669注射液已在中国申报临床,并于7月2日获得受理。公开资料显示,RO7247669是一款靶向PD-1和LAG-3的双特异性抗体,全球范围内正在开展1/2期临床试验。本次是该药首次在中国申报临床。
05
普利制药:双环胺注射液获美国FDA生产批件
7月4日,普利制药公告,收到美国FDA签发的普利制药作为双环胺注射液生产地址的批准通知,标志着普利制药生产的双环胺注射液具备了在美国销售的资格。
06
PD -1/CTLA -4双抗联合VEGFR-2单抗Ib/II期临床获批,治疗胃腺癌或胃食管结合部腺癌
7月5日,康方生物发布公告,称Cadonilimab(PD-1/CTLA-4双抗)及VEGFR-2单抗联合或不联合化疗二线治疗晚期胃腺癌或胃食管结合部腺癌的Ib/II期临床试验获得国家药监局的批准。这是一项开放性、多中心的Ib/II期临床试验。
07
治疗非酒精性脂肪肝!默沙东GLP-1/GCGR双重激动剂挑战司美格鲁肽
近日,美国临床登记网(clinicaltrials)显示,默沙东登记一项Efinopegdutide (MK-6024) vs 司美格鲁肽(semaglutide)治疗非酒精性脂肪肝(NAFLD)的头对头IIa期临床试验。
08
首家!迈博药业「英夫利西单抗」生物类似药即将获批
近日,国家药监局官网显示,迈博药业英夫利西单抗生物类似药(CMAB008)上市申请已处于“在审批”阶段,将于近期获NMPA批准上市。将成为国内首家获批上市的英夫利西单抗生物类似药。
09
乐普生物PD-1普特利单抗申报上市
7月5日,CDE官网显示乐普生物PD-1普特利单抗(pucotenlimab)上市申请获国家药监局受理。是国内第11款申报上市的抗PD-1单抗。
10
新一代抗凝药物!科伦药业FXIa/FXI抗体获批临床
7月5日,CDE公示显示,科伦药业子公司科伦博泰开发的FXIa/FXI单克隆抗体SKB336注射液获得一项临床试验默示许可,拟开发用于预防和治疗血栓栓塞性疾病。根据公告,全球尚未有SKB336同靶点的抗体药物获批上市。
11
汇伦医药「注射用左亚叶酸钠」获批上市
7月5日,中国国家药监局(NMPA)最新公示,汇伦医药子公司上海汇伦江苏药业申报的注射用左亚叶酸钠已正式获批。根据CDE优先审评公示,该产品针对适应症为:1)叶酸拮抗剂(例如甲氨蝶呤)化疗、过量使用时,减轻其毒性、抵消其作用;2)化疗中,与氟尿嘧啶类药物联合使用,用于治疗胃癌和结直肠癌。NMPA官网资料显示,这是中国首款获批的注射用左亚叶酸钠。
12
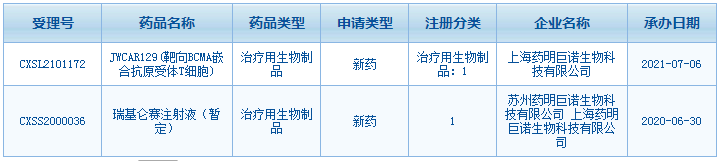
药明巨诺靶向BCMA CAR-T申报临床
7月6日,药明巨诺的一款靶向BCMA的CAR-T疗法JWCAR129的临床试验申请获得NMPA受理。
13
超2亿美元引进!思路迪医药GAS6/AXL抑制剂在中国获批3期临床
7月6日,思路迪医药(3D Medicines)宣布,旗下思路迪药业的3D229注射液已获得中国国家药品监督管理局药品审评中心(CDE)批准,加入全球国际多中心3期临床试验。公开资料显示,3D229是思路迪医药从Aravive公司引进的一款“first-in-class”GAS6/AXL抑制剂,此项合作签约款、以及开发和商业里程碑付款高达2.19亿美元。
14
治疗第二常见皮肤癌,Keytruda再度扩展适应症
7月6日,默沙东(MSD)宣布,美国FDA已批准其抗PD-1抗体疗法Keytruda扩大适应症,单药治疗手术或放疗无法治愈的局部晚期皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)患者。这一批准是基于名为KEYNOTE-629的2期临床试验,试验结果显示Keytruda获得50%的客观缓解率(ORR,n=54)。
15
NK细胞联用CD38抗体治疗多发性骨髓瘤
近日,XNK Therapeutics宣布,其自体自然杀伤(NK)细胞治疗候选药物CellProtect的II期临床研究已纳入第一位患者,该药物与赛诺菲的抗CD38抗体Sarclisa (Isatuximab)联用,以治疗多发性骨髓瘤患者。
16
首个地西泮鼻喷雾剂上市申请获受理
7月6日,康哲药业发布公告,宣布地西泮鼻喷雾剂注册上市许可申请获得国家药监局受理。作为一种急性治疗药物,地西泮鼻喷雾剂用于治疗六岁及以上癫痫患者的间歇性、刻板性癫痫频繁发作活动(即癫痫丛集性发作、急性反复性癫痫发作),这种发作不同于患者通常的癫痫发作模式。
17
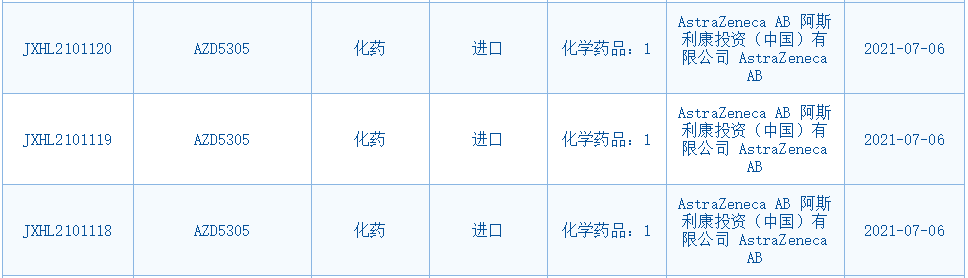
阿斯利康第二代PARP抑制剂AZD5305申报临床
7月6日,CDE官网显示,阿斯利康第二代PARP(高选择性PARP1)抑制剂AZD5305临床申请已获国家药监局受理。
18
圣诺制药双靶点RNAi候选药在美国获批临床
7月6日,圣诺制药(Sirnaomics)宣布,该公司小干扰核酸(siRNA)候选药STP707的临床试验申请已获得美国FDA获准。这是一项多中心、开放、剂量爬坡和剂量扩展1期研究,旨在评价STP707对难治性晚期/转移性或无法手术切除的实体瘤患者静脉给药的安全性、耐受性、药代动力学和抗肿瘤活性。
19
针对三个靶点!基石药业多特异性抗体新药在中国申报临床
7月7日,基石药业宣布,其靶向PD-L1、4-1BB和HSA的多特异性抗体CS2006/NM21-1480在中国的临床试验申请(IND),已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理。根据新闻稿,CS2006/NM21-1480具有成为“best-in-class”免疫治疗骨架分子的潜力,有望成为肿瘤免疫治疗领域极有前景的下一代治疗方法。
20
突破性疗法!赛生药业引进的GD2抗体新药在中国提交上市申请
7月6日,赛生药业(SciClone Pharmaceuticals)与Y-mAbs Therapeutics(下简称“Y-mAbs”)宣布,已向中国国家药品监督管理局(NMPA)正式递交那昔妥单抗(naxitamab-gqgk,Danyelza)的上市许可申请。那昔妥单抗是一款靶向神经节苷脂(GD2)的人源化单克隆抗体,已于去年11月在美国获批治疗神经母细胞瘤患者。值得一提的是,该药曾获FDA授予的优先审评资格、突破性疗法认定和孤儿药资格。
21
IL-12基因疗法与Keytruda联用治疗黑色素瘤,3期临床试验即将展开
日前,OncoSec Medical公司宣布,该公司已与默沙东(MSD)公司达成一项临床试验合作,将开展一项全球性3期临床试验,评估该公司开发的IL-12 DNA质粒疗法TAVO(tavokinogene telseplasmid),与抗PD-1疗法Keytruda联用,治疗晚期转移性黑色素瘤患者的效果。TAVO是一款潜在“first-in-class”抗癌基因疗法,这一试验将用于支持向FDA寻求加速批准。
22
Moderna首款4价季节性流感mRNA疫苗启动临床试验,已完成首批接种
7月7日,Moderna公司宣布,其在研疫苗mRNA-1010的1/2期临床试验已完成首批受试者接种。mRNA-1010是一款4价季节性流感mRNA候选疫苗,靶向世界卫生组织(WHO)建议的四种季节性流感病毒株,包括甲型流感病毒株H1N1和H3N2,和乙型流感病毒株Yamagata和Victoria。新闻稿指出,它是Moderna首款进入临床开发阶段的季节性流感疫苗候选产品。
23
恒瑞1类新药HR20013临床获批,预防化疗后恶心呕吐
7月6日,恒瑞发布公告,称其子公司盛迪医药研发的注射用 HR20013临床试验申请获得国家药监局的批准,用于预防化疗后急性和延迟性恶心、呕吐。
24
岸迈生物管线双抗EMB-02和EMB-06临床进展
7月7日据悉,岸迈生物一家专注于开发创新双抗药物的临床阶段生物制药公司今天宣布,公司管线产品EMB-02(靶向 PD-1 和 LAG-3 的双特异性抗体)针对晚期实体瘤患者的 1/2 期临床研究,和EMB-06(靶向BCMA和CD3的双特异性抗体)针对复发和难治的多发性骨髓瘤患者的1/2 期临床研究,均已经完成首次人体给药。同时EMB-02中国IND申报获得国家药品监督管理局(NMPA)药品审评中心(CDE)批准。

肿瘤新抗原T细胞疗法1/2a期试验中首例患者完成给药
7月1日,一家临床阶段的生物制药Achilles Therapeutics plc公司宣布,在1/2a期的CHIRON临床试验中,完成首例患者入组。CHIRON是一项开放式标签、多中心1/2a期试验,主要用于评估单剂量克隆新抗原T细胞(cNeT)疗法在晚期转移性非小细胞癌(NSCLC)在成人患者中的安全性、耐受性和活性。
创胜集团宣布抗Claudin18.2单克隆抗体TST001项目最新进展
7月2日,创胜集团宣布正在进行的TST001(抗Claudin18.2单克隆抗体)剂量爬坡试验中已经观察到令人兴奋的肿瘤部分缓解。
目前TST001正在美国和中国开展剂量爬坡研究。另外,创胜集团在2021年4月和5月分别启动了在胃癌病人中与二线和一线化疗联合的临床研究。目前一共入组了40多例病人。现有剂量数据表明TST001不管是单药或联合均是安全的。
治疗胃癌,CD47抗体组合疗法达到72%客观缓解率
日前,ALX Oncology公司宣布,其靶向CD47免疫检查点蛋白的在研抗体疗法ALX148,与抗HER2抗体曲妥珠单抗(trastuzumab)和化疗联用,在治疗HER2阳性胃癌或胃食管结合部(GEJ)癌的临床试验中获得积极结果。组合疗法达到72%的客观缓解率。
抗衰老疗法治疗眼科疾病,初步临床结果显示患者视力改善
7月6日,UNITY Biotechnology公司宣布,在晚期糖尿病性黄斑水肿(DME)或湿性年龄相关性黄斑变性(AMD)患者中,其在研Bcl-xL小分子抑制剂UBX1325获得1期临床试验积极结果。
新闻稿指出,UBX1325是首个在眼科临床试验中评估的抗衰老(senolytic)药物。试验表明,大多数接受UBX1325单次注射治疗的患者表现出与疾病进展有关的多项关键性临床指标的快速改善。此外,UBX1325的2a期临床试验已完成首例给药,预计将在2022年上半年获得数据。
靶向诺奖信号通路,RNAi抗癌疗法早期临床结果积极
7月6日,Arrowhead Pharmaceuticals公司宣布,在其在研RNA干扰(RNAi)疗法ARO-HIF2,在治疗晚期透明细胞肾细胞癌(ccRCC)患者的1b期临床试验中,获得积极中期结果。中期分析结果表明,ARO-HIF2具有临床意义地缩小了部分患者的肿瘤体积,降低了HIF2α蛋白水平,并表现出一些潜在的早期疗效。
RNAi联合免疫疗法,乙肝创新组合疗法即将启动2期临床试验
7月6日,Arbutus Biopharma和Vaccitech联合宣布,两家公司已经达成一项临床试验合作协议,将评估一种由RNAi疗法和免疫疗法构成的免疫治疗组合,用于治疗已经接受标准核苷(酸)类逆转录酶抑制剂(NrtI)治疗的慢性乙型肝炎病毒(HBV)感染者。
首次覆盖两大心衰类型,SGLT2抑制剂再获突破
降尿酸效果显著优于非布司他!新型XO抑制剂II期数据公布
双口服联合疗法!阿帕替尼联合吉非替尼3期研究结果发表
新型“人造皮肤”3期临床结果发表,96%烧伤部位不再需要自体移植
特发性肺纤维化药物临床试验显示出良好效果
临床结果证实了DWN12088的安全性和耐受性,也对给药后的血药浓度进行了测定,为进一步临床开发提供了依据。更重要的是,大宇公司已经证实了DWN12088的特异性药效学标志物,这为特发性肺纤维化的治疗提供了有前景的可能性。

01
Nat Commun | 基因工程改造红细胞,开发抗癌疗法

近日,美国 Rubius Therapeutics 公司的研究团队在 Nature Communications 期刊发表了题为:Engineered red blood cells as an off-the-shelf allogeneic anti-tumor therapeutic 的研究论文。该研究将红细胞改造成人工抗原呈递细胞,增强T细胞的抗HPV阳性肿瘤效力,有望实现通过自体红细胞进行抗HPV阳性肿瘤治疗。
更多解读:
T细胞通过T细胞受体(TCR)特异性识别肿瘤抗原,在抗肿瘤免疫中发挥重要作用。近年来,调节或模拟T细胞反应的方法(例如免疫检查点抑制剂和CAR-T疗法)已成为抗癌治疗的重要方法。然而,致命的副作用、耐药性的产生以及自体CAR-T细胞昂贵的生产过程,促使人们继续研究刺激T细胞介导的抗肿瘤反应的替代方法。
红细胞(RBC)因为固有生物相容性而用作输血用途。此外,红细胞与多种免疫特权机制有关,保护它们免受不利的宿主反应。从制造生产的角度来看,造血祖细胞的细胞培养和分化特性允许红细胞大量扩增。此外,通过基因修饰还可以产生表达生物治疗蛋白的工程化人红细胞,用于红细胞疗法。
众所周知,红系前体细胞在形成成熟红细胞的过程中,会丢失细胞核,因此,对红系前体细胞进行的基因修饰后,修饰后的蛋白仍然表达,但遗传物质却不存在了,也就不存在排斥问题,也不用担心修饰过的基因对人体潜在的负面影响。而且,该方法可进行大规模培养扩增,相比CAR-T疗法,成本将大大降低。
首先,研究团队将人CD34+造血祖细胞用慢病毒感染,然后扩增和分化为去核的工程化红细胞,以产生RCT-aAPC。这种红细胞由与MHC I类结合的肿瘤特异性肽、共刺激配体(4-1BBL)和白介素12(IL-12)组成,这些信号都是激活T细胞所必须的。他们发现RCT-aAPC在体外可促进抗原特异性T细胞扩增,记忆形成和对肿瘤细胞的细胞毒性。表明RCT-aAPC可促进T细胞分化为功能性CD8+ T细胞。
使用小鼠模型无法评估RCT-aAPC,因为人的红细胞会在小鼠体内被快速清除。研究团队通过使用链接化学法产生了mRBC-aAPC,发现mRBC-aAPC参与与抗原特异性T细胞的同源相互作用,并表明脾脏可能是体内这种作用的主要部位之一。
体内实验发现注射了mRBC-aAPC的小鼠,与mRBC-CTL相比,肿瘤组织生长减缓,并且可以形成长期记忆以防止肿瘤再发。表明在aAPC上存在的抗原导致了更强大的抗肿瘤作用。重要的是,肿瘤控制与长期记忆的发展和表位的扩散有关,从而对不表达原始靶抗原但在其他方面相同的肿瘤产生疗效。
为了治疗HPV16阳性癌症患者,研究团队基于工程化红细胞开发了RTX-321,这种红细胞表达人白细胞抗原HLA-A和人HPV肽、4-1BBL和IL-12。他们发现RTX-321能诱导HPV抗原特异性原代人T细胞的活化,并且这三种信号都足以促进效应器功能和效应器记忆细胞的分化。
总的来说,该研究开发了一个以基因工程红细胞为基础的aAPC治疗癌症的平台。红细胞已经应用于输血医学几十年。基因工程红细胞可以对患者输注,并被大量生产,而无需使用像TCR-T疗法和CAR-T疗法一样需要复杂且昂贵的生产设备。RCT-aAPC平台展示了广泛的抗癌特性,可作为一种有潜力的癌症免疫治疗方法。
原文链接:
https://www.nature.com/articles/s41467-021-22898-302
Cell | 解决领域多年的难题!多胺代谢是控制 CD4+ 辅助 T 细胞极化为不同功能命运的亚群细胞

2021年7月2日,德国马克斯-普朗克免疫生物学和表观遗传学研究所Erika L. Pearce团队在Cell 在线发表题为“Polyamine metabolism is a central determinant of helper T cell lineage fidelity”的研究论文,该研究表明多胺代谢是控制 CD4+ 辅助 T 细胞 (TH) 极化为不同功能命运的能力的基本过程。
鸟氨酸脱羧酶(多胺合成的一种关键酶)的缺乏导致 CD4+ T 细胞无法分化成正确的亚群规范,多种细胞因子和跨 TH 细胞亚群的谱系定义转录因子的异位表达验证了这一点。多胺通过为合成氨基酸 hypusine 的脱氧hypusine 合酶提供底物来控制 TH 分化,而其中 T 细胞缺乏 hypusine 的小鼠会发展为严重的肠道炎症。多胺-hypusine 缺乏导致广泛的表观遗传重塑,这是由组蛋白乙酰化的改变和重新连接的三羧酸 (TCA) 循环驱动的。因此,多胺代谢对于维持表观基因组以聚焦 TH 细胞亚群保真度至关重要。
激活后,T 细胞增殖形成介导免疫的效应细胞。对于 CD4+ 辅助 T (TH) 细胞,这种克隆扩增与它们分化为具有特殊功能的不同亚群有关,这对于控制病原体和维持组织稳态至关重要。效应 CD4+ TH 细胞的三个主要亚群是 TH1、TH2 和 TH17 细胞。这些细胞在活化和局部微环境线索期间响应来自抗原呈递细胞的信号而从初始T细胞分化。TH 细胞的功能特化是由 T 细胞亚群特异性转录因子 (TF) 的表达赋予的,这些转录因子协调遗传程序以直接产生标志性细胞因子和介导与其他细胞相互作用的表面分子。
简而言之,TH1 细胞表达 TF T-bet 和细胞因子干扰素 (IFN)-γ,并介导对细胞内病原体的反应。TH2 细胞表达 GATA3 和白细胞介素 (IL)-4 并控制蠕虫感染。TH17 细胞合成 RORγt 和 IL-17 并限制细胞外细菌和真菌,特别是在粘膜表面。TH 细胞的第四个子集,调节性 T 细胞 (Tregs),通过抑制效应 T 细胞的激活和增殖来调节免疫,并表达 TF Foxp3。CD4+ T 细胞反应的这种划分,使得病原体驱动不同的 TH 效应程序,需要忠实的 TH 分化对于针对任何给定威胁建立最佳免疫反应而至关重要。
代谢重编程对于 T 细胞激活和分化至关重要。较早的报告表明,多胺合成是 T 细胞活化和增殖的标志,但其功能意义尚未被广泛调查。在哺乳动物细胞中,多胺包含腐胺、亚精胺和精胺。在多胺合成过程中,氨基酸鸟氨酸被限速酶鸟氨酸脱羧酶 (ODC) 转化为腐胺。腐胺然后可以代谢为亚精胺,并最终代谢为精胺。
在这项研究中,调查了多胺代谢在 CD4+ T 细胞分化和功能中的作用。该研究表明,多胺合成的丧失会导致 CD4+ T 细胞可靠分化成功能不同的亚群的能力发生深刻变化。该研究数据表明,多胺代谢在指导 TH 亚群规范中的重要性在于亚精胺作为合成氨基酸 hypusine 的底物的作用。ODC 或负责hypusine 合成的酶的缺失会导致显著的表观基因组变化,这是由增强的组蛋白乙酰化驱动的。这些数据将多胺-hypusine 轴置于 CD4+ T 细胞分化的核心位置。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(21)00708-X
03
STTT | 重大进展!张英驰/程涛/袁鹏飞使用基因编辑技术纠正X 连锁铁粒幼细胞性贫血
2021年7月2日,中国医学科学院/北京协和医学院张英驰,程涛及博雅辑因集团袁鹏飞共同通讯在Signal Transduction and Targeted Therapy(IF=18.19)在线发表题为“Highly efficient gene editing and single cell analysis of hematopoietic stem/progenitor cells from X-linked sideroblastic anemia patients”的研究论文,该研究首次证明了使用基于 CRISPR/Cas9 技术策略来纠正疾病突变并挽救 ALAS2 表达和血红素生物合成。这项研究不仅提供了 ALAS2 突变作为人类 XLSA 发病机制中的致病因素的直接证据,而且还首次以单细胞分辨率提供了来自 XLSA 患者的 CD34+ HSPC 的综合转录谱。因此,该研究结果提供了对 XLSA 发病机制的重要见解。
X 连锁铁粒幼细胞性贫血 (XLSA) 是先天性铁粒幼细胞性贫血最常见的遗传形式,其典型特征是血红素合成减少和骨髓 (BM) 环状铁粒幼细胞的存在,线粒体中含有病理性铁沉积。值得注意的是,大多数报告的 XLSA 男性病例是由编码 5-氨基乙酰丙酸合酶 2 (ALAS2) 的基因突变引起的。造血干细胞 (HSC) 移植是治愈 XLSA 的唯一有效治疗方法,但其局限性包括合适供体的不确定性以及移植相关的死亡率和发病率,例如移植物抗宿主病和免疫排斥。
CRISPR/Cas9技术通过移植转基因 HSCs 在遗传性疾病的临床治疗中显示出巨大的潜力。在这里,该研究开发了一个有效的基因编辑平台来修复来自 XLSA 患者的 CD34+ 造血干细胞和祖细胞 (HSPC) 中 ALAS2 基因的致病突变,为 XLSA 的潜在治疗提供了基础。
在 ALAS2 内含子 1 的 GATA1 结合区域中发现了 A>G 突变,特别是 XLSA 家族,已经证明了该位点在调节 ALAS 表达中的关键作用。因此,该研究首先设计了一系列合成向导 RNA(sgRNA)以及单链 DNA 寡核苷酸供体(ssODN),它们与 Cas9 mRNA 共电穿孔到源自 XLSA 患者的 hiPSC。优化后,下一代测序分析 (NGS) 显示实现了高达 26.3% 的最大同源性定向修复 (HDR) 率。此外,基因编辑细胞中的 ALAS2 mRNA 和蛋白质水平显著增加至健康供体细胞的近 50%,而 GATA1 表达几乎没有变化。
为了评估基因编辑后的多向分化潜力,该研究首先进行了集落形成单位 (CFU) 检测。与模拟处理的细胞相比,基因编辑显著增强了总、CFU-GM(CFU-粒细胞/巨噬细胞)和 BFU-E(爆发形成单位-红细胞)集落的产生,表明这些细胞具有更高的克隆形成潜力。接下来,为了评估体内再增殖潜力,将基因校正的细胞移植到非肥胖糖尿病 (NOD)/Prkdcscid/IL-2Rγnull (NPG) 小鼠中。基因校正组的所有移植小鼠在移植后 10-16 周显示出在多个器官中的植入,表明比模拟组具有更大的植入能力。此外,造血重建分析表明基因校正的细胞保持不同的谱系分布。接下来,移植后 16 周对骨髓样本的基因编辑效率分析显示出高编辑率(通过 HDR 为 34 ± 7.18%),与体外效率相当。此外,为了确定基因编辑系统的特异性,该研究使用无偏的 Digenome-seq 来识别潜在的脱靶位点,并通过靶向 PCR 和 NGS 分析对用 Cas9 mRNA 和 sgRNA 处理的 XLSA hiPSC 进行深入询问。在这些位点未检测到脱靶切割事件,表明缺乏可检测的脱靶事件。
从 XLSA 谱系中的两名患者收集 CD34+ HSPC 用于基因编辑。只有来自年轻患者的 CD34+ HSPC 成功地进行了基因校正。此外,老年 XLSA 患者的造血能力较弱,表明 HSC 功能可能受年龄增长的影响。因此,该研究使用 scRNA-seq 技术分析了来自不同年龄 XLSA 患者的 HSPCs 的组成和转录特征。在这个 XLSA 谱系中,来自三名 XLSA 患者(X037,26 岁,X039,15 岁,X041,4 岁)的 CD34+ HSPC,通过 scRNA-seq 进行了研究,来自三名健康供体 (HD) 的 CD34+HSPC正常控制。数据表明,年龄较大的 XLSA 患者有更多比例的 HSC 停滞在细胞周期的 G1 期,这可能与基因编辑失败和造血异常的可能性更高有关。
总之,该研究首次证明了使用基于 CRISPR/Cas9 技术策略来纠正疾病突变并挽救 ALAS2 表达和血红素生物合成。这项研究不仅提供了 ALAS2 突变作为人类 XLSA 发病机制中的致病因素的直接证据,而且还首次以单细胞分辨率提供了来自 XLSA 患者的 CD34+ HSPC 的综合转录谱。因此,该研究结果提供了对 XLSA 发病机制的重要见解。
原文链接:
https://www.nature.com/articles/s41392-021-00622-304
Sci Adv | 清华大学杜亚楠团队开拓新的方法,治疗糖尿病TP53调控高尔基体分泌协助肿瘤转移

2021年7月2日,清华大学杜亚楠团队在Science Advances 在线发表题为“Exendin-4 gene modification and microscaffold encapsulation promote self-persistence and antidiabetic activity of MSCs”的研究论文,该研究使用 Exendin-4(MSC-Ex-4)(一种胰高血糖素样肽 1(GLP-1)类似物)对 MSC 进行基因工程改造,并证明了它们在 2 型糖尿病 (T2DM) 小鼠模型中增强的细胞功能和抗糖尿病功效。
迄今为止,全世界有超过 4.36 亿人患有糖尿病,预计到 2045 年这一数字将达到 7 亿。2 型糖尿病 (T2DM) 约占糖尿病病例的 90%,其特征是胰岛素抵抗和高血糖,这是由肥胖、缺乏运动、不健康饮食和遗传引起的。当肝脏、肌肉和脂肪组织中的细胞对胰岛素无反应并导致葡萄糖摄取失败时,就会发生胰岛素抵抗。胰腺 β 细胞将通过增加胰岛素产生来补偿胰岛素抵抗,最终导致 β 细胞衰竭和不可逆的高血糖。因此,长期暴露于慢性高血糖会抑制增殖并诱导 β 细胞凋亡,从而导致 β 细胞量减少和 β 细胞功能障碍。
此外,T2DM 与肝功能障碍密切相关,超过 90% 的 T2DM 肥胖患者患有代谢相关性脂肪肝 (MAFLD) 。肝细胞通过将营养物质以糖原和甘油三酯 (TG) 的形式储存起来,在葡萄糖和脂质稳态中发挥着重要作用。在肝脏胰岛素抵抗状态下,胰岛素不能抑制糖异生,但会加速肝细胞中的脂肪酸合成,从而增加肝脏葡萄糖的产生和 TG 的积累。尽管存在 β 细胞和肝细胞功能障碍,但高血糖和高甘油三酯血症会加剧肌肉和脂肪组织的胰岛素抵抗状态,同时引起其他器官和组织的功能障碍。因此,T2DM 与多种并发症密不可分,包括冠心病、中风和视网膜病变。
除了改变生活方式外,还需应用降糖药物以更好地维持 T2DM 患者的正常血糖水平。胰高血糖素样肽-1 (GLP-1) 是一种肠促胰岛素激素,通过与 GLP-1 受体 (GLP-1R) 相互作用来增加胰岛素和抑制胰高血糖素分泌,从而帮助控制血糖波动。然而,GLP-1 因其半衰期短而很少用于 T2DM 治疗,它会在几分钟内被二肽基肽酶-4 迅速降解。第一个获批用于 T2DM 治疗的 GLP-1R 激动剂 Exendin-4 是一种 39 个氨基酸的肽,是一种 GLP-1 类似物,半衰期较长,为 2.4 小时。它通过抑制细胞凋亡和促进细胞增殖来增强 β 细胞质量,从而增加胰岛素分泌量。此外,已证明 Exendin-4 是一种有效的候选药物,可减轻体重,改善糖尿病和 MAFLD。尽管 Exendin-4 在调节血糖和胰岛素反应方面有所改善,但由于肾脏消除,其血浆半衰期仍然有限。因此,需要每天给药两次,这会导致血浆浓度的意外波动和 GLP-1R 的间歇性激活。
尽管上述降糖药物治疗带来了益处,但仍有部分患者无法恢复正常血糖或出现低血糖、腹泻、恶心、呕吐等多种副作用。近年来,基于细胞的疗法已成为对抗包括 T2DM 在内的多种难治性疾病的替代方法。特别是,间充质干/基质细胞 (MSCs) 在一些临床前和临床尝试中已证明其对改善由 T2DM 引起的高血糖、胰岛素抵抗和全身炎症的治疗作用,从而为治疗 T2DM 提供了一种新方案。同时,技术进步仍然迫切需要将基于 MSC 的疗法成功转化为 T2DM 的临床治疗。要克服的主要障碍之一是体内给药后 MSC 的增殖和存活率降低 。
因此,已经研究了多种策略,例如生物材料封装、基因工程和 MSC 预处理 ,以提高存活率、延迟清除动力学和维持体内 MSC 分泌因子。此外,优化 MSCs 的给药途径至关重要,因为静脉内给药的 MSCs 主要滞留在肺部和随后的组织中,导致治疗效果减弱。此外,对 MSCs 在 T2DM 中的治疗机制的全面了解仍然难以捉摸。MSCs 被证明可以促进内源性胰岛素的产生并刺激 β 细胞的增殖。此外,MSC 以其调节免疫反应的能力而闻名,这对于改善由 T2DM 引起的全身炎症至关重要 。
鉴于 Exendin-4 和 MSCs 在治疗 T2DM 方面的上述缺陷,研究人员已经探索了如何协同 Exendin-4 和 MSCs 的治疗益处。MSC 也已用 GLP-1 进行基因修饰,在 T2DM 治疗中显示出优于野生型 MSC 的治疗功效。然而,应该强调的是,这些组合疗法继承了许多缺陷。例如,当与 MSC 一起给药时,单剂量游离 Exendin-4 的治疗效果和持续时间是有限的。此外,考虑到 GLP-1 的半衰期只有 2 分钟,而且治疗 T2DM 需要高有效剂量,预计 GLP-1 修饰的 MSCs 很难显著提高 MSCs 的治疗效果。
在这里,在发现人MSCs表达GLP-1R的基础上,该研究通过慢病毒转导系统构建了Exendin-4基因工程MSCs(MSC-Ex-4)来验证MSC-Ex- 4 分泌的Exendin-4可以通过 GLP-1R 介导的自分泌激活 AMPK 信号通路,从而通过延长其在高糖应激下的存活时间和增强抗糖尿病功效来潜在地促进自我持久性。该研究还探索了有关 MSC-Ex-4 保护胰腺 β 细胞的内分泌作用和 MSC-Ex-4 改善肝细胞功能的旁分泌作用的潜在机制。除了 MSC-Ex-4 分泌的 Exendin-4 外,推测 MSC-Ex-4 的其他分泌组可以减少细胞衰老和凋亡,同时促进胰腺 β 细胞的增殖,以及提高胰岛素敏感性和减少脂质积累。最后,该研究系统地提供了多剂量的游离 MSC-Ex-4,并用可注射的三维 (3D) 明胶微支架 (GMs) 作为细胞封装和递送载体来辅助 MSC-Ex-4,以实现长效治疗效果单剂量局部给药。
总之,该研究结果提供了对 Exendin-4 介导的 MSCs 自我持续性和抗糖尿病活性的机制见解,为 T2DM 提供更有效的基于 MSC 的治疗。
原文链接:
https://advances.sciencemag.org/content/7/27/eabi4379
05
Protein & Cell | 潘文/曹丹合作团队鉴定新型蛋白组氨酸甲基化转移酶,助推表观遗传新兴研究方向

2021年7月6日,中国科学技术大学生医部潘文教授课题组及曹丹副研究员于Protein & Cell在线发表题为 METTL9 mediated N1-histidine methylation of zinc transporters is required for tumor growth 的论文。已于今年4月份post在预印本杂志bioRxiv上。研究人员独立鉴定了哺乳动物中第一个蛋白组氨酸N1位甲基转移酶METTL9,并首次报道了METTL9介导的组氨酸甲基化修饰在肿瘤生长中的功能。与SETD3不同,研究人员发现METTL9的底物众多,并且其修饰底物偏好特定的基序模式XHXH(其中H代表histidine,X代表其他氨基酸)。功能层面,研究人员发现METTL9在很多肿瘤细胞内高表达,在前列腺癌和结肠癌肿瘤细胞内敲除METTL9会抑制肿瘤细胞的生长。机制上,METTL9通过甲基化内质网上的锌离子转运蛋白SLC39A7维持锌离子稳态从而适应肿瘤细胞生长。METTL9这种全新的甲基转移酶可能扩大对于靶向肿瘤潜在新药物的开发研究。
这几项研究刷新了人们对组氨酸甲基化的认知,这种修饰并非只存在特定、少数蛋白,相反,其作为一种广泛存在的调控机制,将是一个新兴研究方向,值得进一步深入探讨和拓展。
首先,研究者在小鼠前列腺癌细胞系RM-1和结肠癌细胞系MC-38中敲除METTL9,研究者发现敲除METTL9后肿瘤细胞在体外的增殖能力减弱。随后研究者将敲除METTL9的细胞系分别接种在免疫缺陷的裸鼠和免疫系统正常的小鼠身上,他们发现敲除METTL9后,肿瘤生长变慢,说明METTL9对肿瘤的生长是必需的。
通过生化实验,研究人员发现METTL9具有甲基化转移酶的活性,并能够甲基化它的相互作用蛋白SLC39A7。通过fine-mapping的手段,研究者发现METTL9甲基化的是SLC39A7上的组氨酸,并揭示SLC39A7上存在很多组氨酸甲基化位点,并且SLC39A7的组氨酸甲基化是在N1位上。通过进一步的生化实验,研究者揭示METTL9甲基化底物具有都包含特定基序XHXH, 第一个氨基酸宽容度较高,除了I/P/V, 其他氨基酸都可以。第三个氨基酸偏好A/C/G/S四个小氨基酸。研究者根据鉴定的底物基序GHA/C/G/SH进行了搜索,发现很多蛋白都包含METTL9的识别基序,通过实验验证证明了它们都可能是METTL9的底物。通过对含有基序的底物进行GO分析,研究者还发现锌离子转运家族大都含有这种特定的基序,暗示METTL9通过甲基化锌离子转运家族来调控胞内的锌稳态。
研究者进一步对METTL9促进肿瘤生长的分子机制进行了研究,作者发现敲除METTL9后细胞内的锌离子浓度升高。通过转录组测序手段,研究者们发现敲除METTL9后调控细胞周期相关的通路蛋白下调而与ER stress相关的通路蛋白上调。通过进一步的研究,作者发现SLC39A7上的两个组氨酸位点在METTL9调控锌离子浓度上有重要作用,表明METTL9通过甲基化锌离子转运蛋白调控锌离子稳态,从而进一步影响细胞增殖。除此之外,研究者们还发现,肿瘤细胞中的METTL9高水平与更差的生存率相关。但在肿瘤免疫微环境中,大多数肿瘤免疫环境中的METTL9很低,说明METTL9在免疫微环境中受到一定的调控,它在免疫微环境中的下调可能会帮助肿瘤发展。综上所述,这项工作鉴定了蛋白组氨酸N1甲基化转移酶METTL9,并发现其可促进肿瘤生长,为治疗肿瘤提供了潜在新的靶点,同时也揭示了组氨酸甲基化的多样性和复杂性。
在Protein & Cell论文整理投稿的过程中,来自瑞典、日本和德国的三个小组合作也发现了METTL9这个蛋白组氨酸N1位的甲基化转移酶。他们的论文题目为The methyltransferase METTL9 mediates pervasive 1-methylhistidine modification in mammalian proteomes发表在今年2月9号的Nature Communications上【1】。这篇文章侧重通过质谱手段鉴定体内的蛋白组氨酸N1位的甲基化,他们也同样发现了大量的METTL9的底物。通过生化手段,他们把METTL9的识别基序鉴定为HXH,其中偏好A/G/N/S/T,与Protein & Cell论文中的A/C/G/S有所不同,分析原因可能是XHXH基序周围的氨基酸对它的甲基化也有一定的影响。但是该论文在甲基化转移酶METTL9的生物学功能上没有做深入研究。
另外,今年5月22号在NAR Genomics and Bioinformatics上也发表了自瑞士的课题组论文 Large-scale identification of protein histidine methylation in human cells ,对已有的蛋白甲基化谱数据库进行了分析【2】。文中也发现组氨酸甲基化普遍存在于细胞和组织中。80%的组氨酸甲基化蛋白只包含一个组氨酸甲基化位点,被甲基化的组氨酸具有单一空间的性质。文章也揭示了含有组氨酸甲基化的蛋白包含很多锌结合蛋白,和Protein & Cell文章分析的结果类似。
除上述三篇论文以外,今年2月份NAR上还发表了题为Human METTL18 is a histidine specific methyltransferase that targets RPL3 and affects ribosome biogenesis and function 的论文【3】。METTL18是酵母中Hpm1的同源物,它甲基化RPL3的活性一直都没得到证实。这篇文章发现RPL3需要在核糖体复合体上才能被甲基化,从而把METTL18鉴定为第二个人源的组氨酸甲基化转移酶。
综上所述,连续发表的这几篇文章揭示了蛋白组氨酸甲基化酶的新篇章,极大地扩展了含有甲基化组氨酸的蛋白底物,为体内蛋白组氨酸甲基化的研究揭开了新的序幕。
Protein & Cell研究主要由中国科学技术大学生命科学与医学部附属第一医院,生命科学院,西湖大学等单位共同完成。潘文教授,曹丹副研究员为Protein & Cell论文的共同通讯作者。中国科大生命科学与医学部博士生吕梦月,曹丹副研究员为论文共同第一作者。
原文链接:
https://doi.org/10.1007/s13238-021-00857-4
参考文献:
1. Davydova E, Shimazu T, Schuhmacher MK, Jakobsson ME, Willemen H, Liu T, et al. The methyltransferase METTL9 mediates pervasive 1-methylhistidine modification in mammalian proteomes. Nat Commun. 2021;12(1):891.
2. Kapell S, Jakobsson ME. Large-scale identification of protein histidine methylation in human cells. NAR Genom Bioinform. 2021;3(2):lqab045.
3. Malecki JM, Odonohue MF, Kim Y, Jakobsson ME, Gessa L, Pinto R, et al. Human METTL18 is a histidine-specific methyltransferase that targets RPL3 and affects ribosome biogenesis and function. Nucleic acids research. 2021;49(6):3185-203.06
STTT | 南方科技大学等多单位合作,邹畅/高祥发现三阴性乳腺癌新的潜在治疗靶点

2021年7月5日,南方科技大学邹畅及四川大学高祥共同通讯在Signal Transduction and Targeted Therapy(IF=18.19)在线发表题为“Kinectin 1 promotes the growth of triple-negative breast cancer via directly co-activating NF-kappaB/p65 and enhancing its transcriptional activity”的研究论文,该研究结果阐明了 KTN1 基因在 TNBC 肿瘤发生和进展中的新机制。KTN1 可能是 TNBC 治疗发展的潜在分子靶点。
三阴性乳腺癌 (TNBC) 是一种乳腺癌 (BCa) 亚型,不表达雌激素受体 (ER)、孕激素受体 (PR) 和人表皮生长因子受体 2 (Her2) 蛋白。在所有 BCa 亚型中,TNBC 的复发和转移率最高。虽然 TNBC 仅占所有 BCa 的 15% 左右,但它仍然是最难治疗的 BCa 亚型。TNBC 治疗的挑战主要归因于其高细胞侵袭能力并且缺乏用于早期诊断和及时治疗的有效生物标志物。因此,需要付出更多努力来探索 TNBC 细胞侵袭和疾病进展的分子基础。
Kinectin 1 (KTN1) 是一种与驱动蛋白相互作用的多功能蛋白质,参与细胞器运动和细胞板粘着斑生长等许多细胞动力学过程。KTN1 在调节基因转录中的分子作用在肿瘤中仍然未知。最近的研究表明,KTN1 在皮肤鳞状细胞癌中的过度表达和 KTN1 在这些肿瘤细胞中的抑制可以通过降低表皮生长因子受体 (EGFR) 的蛋白质表达来抑制其细胞增殖。这些发现暗示 KTN1 可能与肿瘤进展有关。然而,KTN1 促进癌细胞生长的分子机制在很大程度上仍未被探索。
炎症反应在乳腺癌的发展中起着关键作用。核因子 kappaB (NF-κB) 复合物由五个亚基 p50、p52、RelA (NF-κB/p65)、RelB 和 c-Rel 组成,发挥着重要作用,在调节炎症反应中起关键作用。有趣的是,NF-κB 信号通路在 TNBC 中被激活。在典型的 NF-κB 通路中,IκB 激酶 β (IKKβ) 催化的磷酸化 IκBα 受到 TNFα、IL-1β 或 IL-6 的刺激。IκBα 蛋白复合物的降解导致 p50-p65 蛋白的核易位。大多数 TNBC 由基底样和低密蛋白 BCa 组织组成。先前的研究表明,基底样 BCa 肿瘤起源于管腔祖细胞,与基底肌上皮细胞相比,导致 NF-κB 活化水平增加。然而,NF-κB 信号通路在调节 TNBC 肿瘤发生中的分子机制尚不清楚。
众所周知,慢性刺激和炎症可能导致癌症。NF-κB 的激活被包括促炎细胞因子在内的外部刺激迅速诱导。细胞因子和趋化因子,包括白细胞介素 (IL)-6 和 CXCLs 被发现有助于 BCa 生长、浸润和化疗耐药性,并参与 NF -κB 信号通路。先前的研究表明,高水平的 CXCL8 表达加速了胃肠道癌症中的肿瘤细胞增殖、血管生成和转移。在 BCa 中,已发现自分泌和旁分泌机制激活炎症细胞因子有助于引发其侵袭性生长、干性和化学抗性。然而,涉及释放这些细胞因子的上游事件的分子机制尚不清楚。
在这项研究中,发现 KTN1 在 TNBC 肿瘤标本和细胞中均显著上调,并且这种上调与 TNBC 患者的不良预后呈正相关。基因功能获得和功能丧失分析均表明 KTN1 可以在体外和体内促进 TNBC 细胞的生长和侵袭。此外,KTN1 可以增强促炎细胞因子 CXCL8 的基因转录并上调其在 mRNA 和蛋白质水平上的表达。
重要的是,该研究发现了 KTN1 蛋白结构域的两个潜在核定位信号 (NLSs),发现 KTN1 蛋白可以与细胞核中的 NF-κB/p65 相互作用并增加其磷酸化,这可以在 TNBC 中的 CXCL8 基因启动子上进一步激活 NF-κB/p65 的转录活性。总的来说,该研究结果突出了 KTN1 在促进 TNBC 细胞生长方面的全新转录调节功能,这可能为开发 TNBC 治疗的新策略提供一些启示。
原文链接:
https://www.nature.com/articles/s41392-021-00652-x
07
Mol Cancer | 重大进展!海军军医大学杨彦勇/高福/蔡建明发现同源重组介导的 DNA 修复以增强抗癌性

2021年7月5日,海军军医大学杨彦勇,高福及蔡建明共同通讯在Molecular Cancer (IF=27.40)在线发表题为“Long non-coding RNA ANRIL promotes homologous recombination-mediated DNA repair by maintaining ATR protein stability to enhance cancer resistance”的研究论文,该研究发现lncRNA ANRIL 通过介导 DNA 损伤的同源重组 (HR) 修复来促进癌症抗性。总之,靶向 ANRIL 会导致 ATR 降解,这将进一步导致 HR 修复缺陷。因此,这些发现可以为实现新机制和获得潜在的治疗应用提供线索,不仅适用于放疗,也适用于与 ATR 相关 HR 修复相关的化疗。
更多解读:
异常增强的 DNA 损伤修复导致多种癌症的治疗耐药 。最近,长链非编码 RNA (lncRNA) 已被证明是 DNA 损伤修复不可或缺的参与者,并为克服癌症耐药性提供了新的靶点。然而,大多数 lncRNA 在 DNA 损伤修复中的确切作用仍然未知。在这里,该研究发现lncRNA ANRIL 通过介导 DNA 损伤的同源重组 (HR) 修复来促进癌症抗性。
具有高 ANRIL 表达的肺癌是全世界死亡的主要原因,并被选为模型来研究 ANRIL 在 DNA 损伤修复和治疗抵抗中的作用。首先,与来自 80 对临床标本的邻近正常组织相比,在肺癌组织中发现 ANRIL 显著升高。与正常 BEAS-2B 细胞相比,肺癌细胞中也证实了 ANRIL 的高表达。通过分析来自 TCGA 数据库的数据,还发现 ANRIL 在肺鳞状细胞癌中上调,但在腺癌中没有上调。此外,电离辐射 (IR) 和其他 DNA 损伤试剂,ANRIL 表达大大增加。这些数据表明,增加的 ANRIL 表达赋予肺癌细胞对电离辐射的抵抗力。
然后,该研究探索了 ANRIL 是否在 DNA 损伤修复中发挥了关键作用。在辐照后的 ANRIL-KD 细胞中,在 8 h 时观察到的 DNA 损伤比在 NC 细胞中更多。相比之下,辐照后在 ANRIL-OE H460 细胞中观察到较少的 DNA 损伤。这些结果表明 ANRIL 的缺失导致 IR 后未修复的 DNA 损伤。在了解了 ANRIL 在 DNA 损伤修复过程中的必要性后,本研究继续进一步研究了 ANRIL 在 DNA 损伤反应 (DDR) 中的确切功能。结果表明 ANRIL 是 DDR 和增加肺癌细胞抗癌性所必需的。
为了探索 ANRIL 对体内抗癌性的影响,将 NC 和 ANRIL 敲低的 H1299 细胞以及过表达载体和 ANRIL 的 H460 细胞皮下注射到裸鼠中。ANRIL 敲低结合局部照射导致肿瘤体积曲线和重量方面的肿瘤生长减少。一致地,与载体组相比,ANRIL-OE H460 细胞显示出肿瘤对放疗的抵抗力增加。这些体内实验结果证实了 ANRIL 在放疗抵抗中的作用。
ANRIL 缺陷细胞中 ATR 和 HR 修复的失活促使研究这些影响的潜在机制。通过 RNA FISH 测定发现 ANRIL 位于细胞核中,这表明它可能在直接调节 DNA 损伤修复中发挥作用。为了确定 ANRIL 在 HR 修复过程中是否与其直接靶标相互作用,通过使用 ATR-、RAD51- 和 RPA2 特异性抗体进行了 RIP 实验。令人惊讶的是,ANRIL 富含 ATR 特异性抗体而不是 RPA2 或 RAD51 抗体免疫沉淀的蛋白质-RNA 复合物,表明 ANRIL 可能在调节 ATR 功能中发挥作用。进一步的研究表明,ATR 与 ANRIL 的结合不依赖于其磷酸化水平。此外,ANRIL 与 ATR 蛋白的直接结合通过 RNA pulldown 测定得到证实。lncRNA最重要的功能之一是与蛋白质结合,从而导致功能改变;此外,尚未报道任何与 ATR 结合的 lncRNA。
为了确定与 ATR 相互作用的 ANRIL 的详细序列,基于使用 RNA 折叠软件预测的二级结构生成了 ANRIL 功能区的不同片段。通过 RNA pulldown 测定,5'-区域(0-880 bp 和 881-1640 bp)被鉴定为与 ATR 蛋白结合所必需的。这些结果表明 ANRIL 在 N 端直接与 ATR 结合。
作为 DDR 中的关键激酶,ATR 可能解释了 ANRIL 在 DNA 损伤修复中发挥的关键作用。该研究通过在 ANRIL-KD 细胞中过表达 ATR 进行拯救实验,并在 ANRIL-OE 细胞中进行 ATR 敲低来改变 ATR 的表达。数据显示,ANRIL-KD 细胞中的 ATR 过表达显著提高了 DNA 修复和细胞存活的功效。然而,ANRIL-OE 细胞中的 ATR 敲低抑制了 DNA 修复和细胞存活。这些结果表明 ANRIL 直接结合并保护 ATR 免受泛素化介导的降解,然后,ANRIL 促进 HR 修复和抗癌。
总之,靶向 ANRIL 会导致 ATR 降解,这将进一步导致 HR 修复缺陷。因此,这些发现可以为实现新机制和获得潜在的治疗应用提供线索,不仅适用于放疗,也适用于与 ATR 相关 HR 修复相关的化疗。
原文链接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-021-01382-y08
NCB | 黏着斑上的“守门员”—CCM3调节机械传导和YAP/TAZ信号

2021年7月5日,来自瑞典隆德大学的Chris D. Madsen团队在Nature Cell Biology上在线发表题为“CCM3 is a gatekeeper in focal adhesions regulating mechanotransduction and YAP/TAZ signalling”的文章,发现定位于CAF黏着斑的CCM3(cerebral cavernous malformations 3)可以通过减弱FAK/Src诱导的信号转导和YAP/TAZ激活而在CAF中充当机械传导的“守门员”,证明CCM3是机械信号驱动的YAP/TAZ信号的调节因子,控制着肿瘤的进展和干细胞分化。
PDCD10/CCM3基因编码的支架蛋白在大多数组织中普遍表达,研究发现CCM3蛋白参与调节上皮细胞和内皮细胞的肌动球蛋白收缩,那么CCM3是否也有助于CAF诱导的ECM重构呢?本文研究人员首先从头颈癌、外阴癌和宫颈癌患者中分离得到CAF(分别为HN-CAF、V-CAF、Cer-CAF),用siRNA敲低CCM3,并在由I型胶原和基质胶混合而成的致密三维凝胶中培养,结果显示CCM3的缺失显著增加了三种CAF细胞株的凝胶收缩,CAF激活增强,伴随着更强烈的收缩机制。同时,通过在密集的垂直纳米线阵列上电镀细胞,并测量细胞在纳米线上移动时纳米线尖端的位移,获得对CAF施加牵引力的能力的测量,结合单细胞分析,研究人员发现CCM3的缺失显著增加了V-CAF施加的牵引力。而CCM3的缺失显著诱导了三种人CAF中的YAP/TAZ核转运,使之激活。这些发现表明,CCM3可以调节人CAF中向ECM传递的内在力,并且是YAP/TAZ激活的负调控因子。
进一步实验结果显示,CCM3对YAP/TAZ的调控不依赖于Hippo激酶、STRIPAK(CCM3是STRIPAK复合物的一个组成部分,该复合物被证明可调节Hippo激酶的活性)和CCM复合物,于是,研究人员开始将注意力转向非典型的机械转导途径。利用不同抑制剂阻碍肌动球蛋白骨架可以完全挽救由CCM3缺失造成的YAP/TAZ核定位及CAF诱导的凝胶收缩,由此表明CCM3的缺失是通过刺激肌动球蛋白细胞骨架的收缩性来激活YAP/TAZ的。同时,研究发现CAF中的CCM3是内在细胞骨架张力的负调控因子。
肌动球蛋白细胞骨架内产生的张力可以通过黏着斑传递,从而诱导整合素介导的周围基质重构。本文研究结果显示,CCM3的缺失可以导致FAK/Src/phospho-paxillin通路的激活上调,从而改变黏着斑的大小和生长速率。而结合CCM3缺失后牵引力的增加,研究人员指出CCM3可能可减弱由内而外的信号传导,并缓冲肌动球蛋白网络、黏着斑和ECM之间的耦合。进一步地实验发现,细胞质中的CCM3定位于黏着斑,TAP/TAZ的激活与黏着斑中的CCM3的水平呈负相关,并且CCM3在黏着斑中以相互排斥的方式与FAK竞争性结合桩蛋白(paxillin,一种涉及胞外基质细胞黏附(黏着斑)位点上肌动蛋白-膜附着的细胞骨架蛋白),像“守门员”一样调节着FAK/Src的激活和机械转导。
最后,本文研究人员从两方面阐明了CCM3负调控TAP/TAZ信号的重要作用。间充质基质/干细胞(MSC)的分化命运受到环境弹性特征和YAP/TAZ激活状态的强烈影响,其在软环境中倾向于向脂肪细胞分化,而在坚硬基质中更易于向成骨细胞分化。本研究发现,CCM3的缺失可以显著增强MSC向成骨细胞的分化,尤其在软基质中的分化,抑制MSC向脂肪细胞的分化,并且是FAK依赖性的,由此表明CCM3介导的YAP/TAZ调控可直接影响干细胞的命运和分化。此外,小鼠体内成瘤实验发现,虽然成纤维细胞群中CCM3的缺失没有影响肿瘤的生长,但是肿瘤微环境经历了明显重塑,纤维胶原水平增加,成纤维细胞激活,肿瘤转移负担增强。由此表明CCM3是CAF诱导的体内生物力学的调节因子,CCM3的不稳定会产生不利的肿瘤微环境和转移扩散影响。
综上所述,本研究证实CCM3是正常成纤维细胞、CAF和MSC中YAP/TAZ信号的机械调节因子,作为机械转导的“守门员”,在黏着斑上与FAK竞争性结合桩蛋白,减弱FAK的激活和YAP/TAZ信号,影响肿瘤的进展和干细胞分化,从而为癌症和再生医学提供了新的潜在靶点。
原文链接:
https://doi.org/10.1038/s41556-021-00702-0
09
Nat Methods | 单细胞代谢组平民化——SpaceM高通量揭秘单细胞的代谢状态

2021年7月5日,来自美国UCSD的Theodore Alexandrov教授团队在Nature Methods上发表题为 SpaceM reveals metabolic states of single cells 的工作,他们开发了一种原位单细胞代谢组学的开源方法,基于MALDI 成像质谱,结合荧光信号和形态空间特征,实现了单细胞、高通量、原位代谢组分析,每小时能从1000个细胞中检测出100种以上的代谢物。
SpaceM 方法原理
为了使单细胞代谢组学分析大众化,作者利用商品化的MALDI成像质谱和光学显微镜开发了一种开源方法,SpaceM。基于MALDI的单细胞代谢组学分析的难点是将代谢产物强度的分配给单个细胞。为了解决这一问题,作者利用光学显微镜进行图像分割和校准,然后MALDI成像分析代谢物。
对于SpaceM,细胞需要在显微镜兼容的基质上培养,然后固定、荧光染色和干燥。SpaceM从获取显微图像开始,称为pre-MALDI。pre-MALDI图像为细胞细分提供了广泛的表型信息,包括单个细胞的荧光强度和形态学特性。接着,用MALDI基质喷洒样品,MALDI成像质谱对样品进行非目标分析,检测其中代谢物和脂质。MALDI采样后会有明显的烧蚀痕迹,可以用于确定产生信号的区域。因此,进行第二轮显微成像(post-MALDI)与第一轮共校准,并利用新开发的高精度图像校准方法,实现亚微米精度的分辨率。最终,SpaceM提供了一个单细胞空间分子矩阵,并为每个细胞提供了在其固有的空间环境中量化的多重信号,包括非目标代谢谱、荧光强度和空间形态特征。
通过预测单细胞分辨率的细胞类型来验证SpaceM
为了验证SpaceM的有效性,作者仅基于单细胞代谢图谱,预测了共培养的人HeLa细胞和小鼠NIH3T3成纤维细胞的细胞类型。为了验证预测的准确性,细胞类型利用mCherry和GFP强度之间的线性边界确定(两种细胞分别持续表达H2B-mCherry和GFP)。SpaceM提供了445个HeLa和400个NIH3T3共培养细胞的88种代谢物的代谢图谱,基于单细胞代谢谱的鉴定精确度达到91%。
除了表征细胞类型外,作者还使用SpaceM来识别脂肪酸刺激下分化的人肝细胞(dHepaRG)细胞系的代谢状态。该细胞模型常用于NAFLD(非酒精性脂肪肝)研究,其中肝细胞经历脂质代谢重塑和细胞内脂肪滴的积累,称为脂肪变性。进一步,NAFLD可进展为NASH(非酒精性肝炎),肝脏中的脂肪会引起炎症,即肝炎和肝细胞损伤。随着时间的推移,这会导致肝纤维化或瘢痕,肝硬化和肝癌。SpaceM提供了来自2840个dHepaRG细胞的740个代谢物的谱图。UMAP和非监督聚类的代谢谱显示了两个不同的亚群的特征【1,2】。
炎症环境中脂质刺激肝细胞代谢状态的表征
肝细胞中的脂质组成在稳态条件下受到严格调控。然而,过量的游离脂肪酸和其他应激源,包括炎症细胞因子,会促进异常的脂质储存,最终导致NASH。为了研究NAFLD向NASH转变过程中单个肝细胞的代谢重构情况,作者分析了四种情况下的细胞:
(1)CTRL:不做处理的控制组,模拟稳态状态的;
(2)+FA:以油酸和棕榈酸为刺激剂,模拟无炎症的NAFLD;
(3)+FA+IL17A:以FA和炎性细胞因子IL17A为刺激剂,模拟NASH;
(4)+FA+IL17A+TPCA1:以FA,IL17A及抑制其炎症作用的TPCA1为刺激剂。
SpaceM提供了来自29,738个肝细胞的740个代谢物的谱图,非监督聚类显示了三个主要聚类,分别代表稳态、过渡态和脂肪代谢状态。伪时间分辨的单细胞代谢谱图可以用于表征肝细胞从稳态到脂肪态的发展。代谢状态标记物随着时间逐渐变化,表明各状态内的代谢均存在异质性。作者还鉴定到了不同状态的特定代谢标志物,并用LC-MS/MS进一步验证。
与先前的方法相比,SpaceM有几个优点:首先,SpaceM可以使用任何现代的MALDI成像源,而不需要特殊的仪器。第二,SpaceM允许细胞在其原生培养环境中进行分析,从而避免任何扰动,并提供形态特征和细胞与细胞之间的关系。第三,提供亚细胞精度的分辨率。
总之,开源的SpaceM方法不仅填补了蓬勃发展的单细胞代谢组学领域的巨大空白,而且被用于表征dHepaRG肝细胞的代谢异质性和状态。SpaceM简单的设计、低的仪器要求和良好的兼容性可能会为单细胞代谢组学的平民化铺平道路。
原文链接:
https://doi.org/10.1038/s41592-021-01198-0
参考文献:
【1】 Tanner, N. et al. Regulation of drug metabolism by the interplay of inflammatory signaling, steatosis, and xeno-sensing receptors in HepaRG cells. Drug Metab. Dispos. 46, 326–335 (2018).
【2】Anstee, Q. M., Reeves, H. L., Kotsiliti, E., Govaere, O. & Heikenwalder, M. From NASH to HCC: current concepts and future challenges. Nat. Rev.Gastroenterol. Hepatol. 16, 411–428 (2019).10
Cell Metab | 胡文祥等揭示预测糖皮质激素类药物代谢相关副作用的遗传位点

2021年7月6日,来自生物岛实验室的胡文祥团队和宾夕法尼亚大学佩雷尔曼医学院的Mitchell Lazar院士团队在Cell Metabolism上发表了题为Individual-specific functional epigenomics reveals genetic determinants of adverse metabolic effects of glucocorticoids的研究论文,该研究运用病人干细胞分化的脂肪细胞和肝细胞作为模型,结合功能基因组学工具,揭示了影响GC个体特异性反应的遗传基础。这是继他们2019年1月在Cell Stem Cell上发表文章Patient adipose stem cell-derived adipocytes reveal genetic variation that predicts anti-diabetic drug response 后的又一拓展性研究(详见BioArt报道:Cell Stem Cell丨胡文祥博士等揭示个体遗传变异对糖尿病药物不同响应的分子机制)。这些系统的研究表明了干细胞和功能基因组学在药物精准医疗研究领域的重要价值。
GC通过靶向多种组织如脂肪和肝脏中的糖皮质激素受体 (GR) 发挥作用。过量的GC会导致库欣综合征 (Cushing’s syndrome) ,主要表现为中心性肥胖,并伴有高血糖、血脂异常和肝脂肪变性。GC对脂肪组织中的脂质代谢有着复杂的调控,其促进甘油和脂肪酸的产生,为肝脏糖异生提供底物和能量。GC 还通过与其他因素如胰岛素协同作用直接调节脂肪生成基因的表达。在肝脏组织中中,GC 则激活GR结合到糖异生关键基因 PCK1 和 G6PC 的启动子区域,增加肝脏葡萄糖的产生,导致接受GC治疗的个体患糖尿病。GC 还增加胰岛素刺激的脂肪生成并减少肝脏中的脂肪分解,导致库欣病患者和接受外源性GC 治疗的患者中发生高甘油三酯血症和肝脂肪变性的现象。基于GC在脂肪和肝脏组织中的重要作用,在这项研究中,研究人员构建了两套具有不同遗传背景来源的脂肪细胞和肝细胞平台来研究GC药物的个体特异性反应。分别为肥胖病人来源的脂肪干细胞分化的脂肪细胞,及人诱导多能干细胞分化的肝细胞。
研究人员进而检测不同病人来源的脂肪细胞和肝细胞是否对GC药物地塞米松(Dexamethasone)反应不同。通过转录组学分析,作者发现不同个体来源的脂肪细胞和肝细胞呈现出个体特异性的药物反应。进一步的研究发现,GR在基因组的结合也呈现出一定的个体特异性。通过生信分析,作者发现这些个体特异性的GC药物反应是由个体特异的GR在基因组上的结合驱动的。同时非常有意思的是,脂肪细胞和肝细胞也展示出细胞类型特异的GC药物反应,这和GR在脂肪细胞和肝细胞的细胞类型特异的基因组结合是相一致的。De novo motif分析揭示细胞谱系决定因子如NF1、HNF4可能介导细胞类型特异的GR激活。
作者进一步发现数百个SNPs可以通过影响GR或它的辅助转录因子的结合域 (motif) 来调控GR在基因组上的结合,从而影响GC的药物反应。这些SNPs富集在多种代谢性状 (metabolic traits) 如BMI、胆固醇、糖尿病和甘油三酯等。同时,研究人员注意到只有部分的个体特异的GR结合位点内含有影响GR基因组结合的SNPs。为了探讨其它影响个体特异GR功能的因素,研究人员进行了ATAC-seq和ChIA-PET实验。他们揭示部分SNPs可以通过影响较远位置的转录因子的结合从而调节GR在基因组上的结合;而另外一部分SNPs是则通过影响染色质的空间结构来调控GR的功能。
研究人员通过一系列的细胞与分子实验验证了SNPs调节GR功能的活性。最后他们检测这些发现是否可以预测病人使用GC药物后的代谢相关副作用。在St. Jude儿童医院的400个临床上使用GC药物的急性淋巴细胞白血病儿童病人中,及宾夕法尼亚大学biobank中,他们发现rs10980797、rs2060982可以预测病人服用GC药物后出现高血糖的风险;rs10881935和病人出现高血脂的现象紧密相关;rs55830753和病人胆固醇水平高低有关;rs13038139可以预测病人服用GC药物后BMI指数的高低;但这些SNPs不影响GC药物对病人相关病征的疗效。
综上,作者对不同个体来源的脂肪细胞和肝细胞的研究揭示了细胞类型特异性和个体特异性的 GC 反应,为识别具有严重药物不良反应的人群奠定了基础。更为重要的是,研究人员专注于研究靶向特定转录因子的药物以及和药物不良反应密切相关的细胞类型,这些“有偏见”的研究方法大大提高了发现风险等位基因的概率。这些研究思路为使用 GC 药物治疗癌症和免疫疾病的个性化和精确医疗提供了前进方向。
生物岛实验室胡文祥博士为第一作者和共同通讯作者,宾夕法尼亚大学江纯阶博士为共同第一作者,Mitchell Lazar院士为本论文的通讯作者。工作得到了宾夕法尼亚大学Mitchell Lazar实验室其他成员、Daniel Rader团队及St. Jude儿童医院Mary Relling团队的大力支持。
原文链接:
https://doi.org/10.1016/j.cmet.2021.06.004其他最新文章推荐
Gene therapy knockdown of Hippo signaling induces cardiomyocyte renewal in pigs after myocardial infarction

The Mediator Subunit MED20 Organizes the Early Adipogenic Complex to Promote Development of Adipose Tissues and Diet-induced Obesity

Metabolic Modeling of Single Th17 Cells Reveals Regulators of Autoimmunity

资料整理:西湖生物医药综合办公室
文章来源:公开信息搜集
