关注生命科学领域突破进展,聚焦热点政策,观澜创新治疗产品行业动态,耕耘于分秒,收获于细微,做乘风破浪的生物医药人!

01
关于公开征求《化学药品和治疗用生物制品说明书中儿童用药相关信息撰写的技术指导原则(征求意见稿)》意见的通知

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=9e1eec1fc2b7c421
02
公开征求《急性非静脉曲张性上消化道出血治疗药物临床试验技术指导原则》意见的通知

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=ae434b438d0aba94
03
关于发布《化学仿制药参比制剂目录(第四十三批)》的公示

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=6f0ee2c44d684170
04
关于药品专利纠纷早期解决机制相关专利信息登记平台公开测试等有关事宜的通知
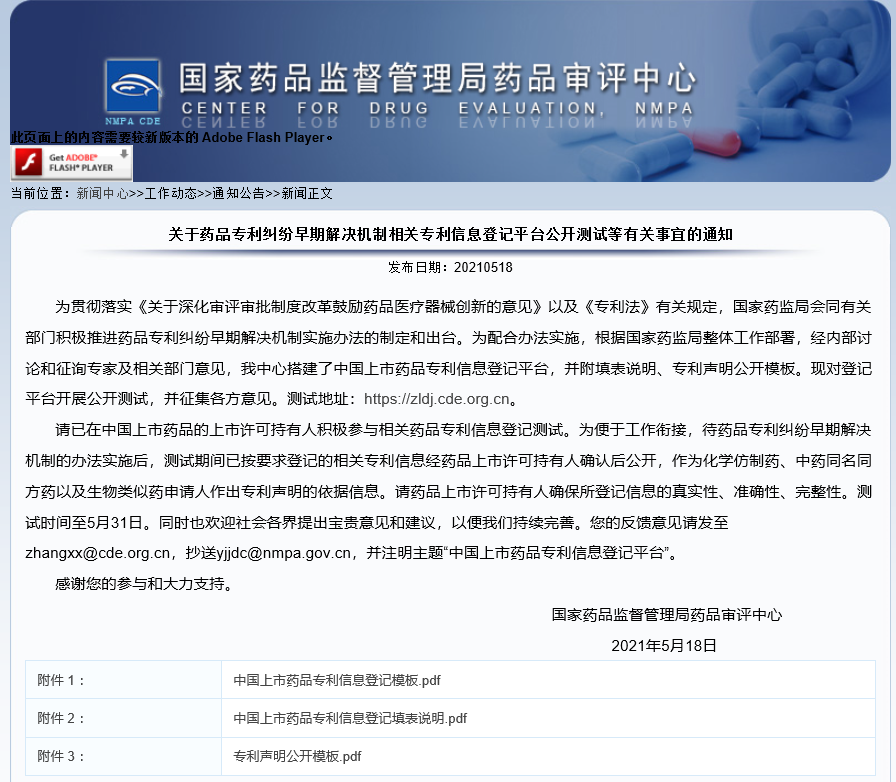
通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=464a59511b09ddfc
05
关于发布《化学仿制药参比制剂目录(第四十四批)》的公示

通知原文:http://www.cde.org.cn/news.do?method=viewInfoCommon&id=69211cfad466ffcb
01
终成正果,双重机制缓释止痛药获美国FDA批准
5月15日,Heron Therapeutics公司宣布,美国FDA批准了该公司开发的Zynrelef(HTX-011)缓释止痛剂上市,为做完拇囊炎切除术、开放式腹股沟疝修补术或全膝关节置换术之后的患者提供长达72小时的镇痛效果。新闻稿指出,Zynrelef是美国FDA批准的首个具有双重作用的缓释局部麻醉剂。它是一种局部麻醉剂布比卡因(bupivacaine)和低剂量非甾体抗炎药(NSAID)美洛昔康(meloxicam)的固定剂量组合。与当前标准治疗相比,布比卡因和美洛昔康之间的协同作用可让术后患者经历的疼痛(包括重度疼痛)显著减少,且术后不需要使用阿片类药物镇痛的患者显著增加。此前,Heron公司曾经两度收到FDA的CRL,如今这款创新长效止痛药终于冲过了终点线。
02
“近15年来首个新补体药物类型”,FDA今日批准首款C3补体抑制剂
5月15日,Apellis Pharmaceuticals公司宣布,美国FDA已批准Empaveli(pegcetacoplan)上市,用于治疗初治阵发性睡眠性血红蛋白尿症(PNH)成人患者,以及从接受C5抑制剂治疗转换为接受Empaveli治疗的PNH患者。新闻稿指出,这是首个FDA批准用于治疗PNH的C3靶向疗法。
03
首个选择性PI3Kδ抑制剂申报上市,恒瑞/璎黎药业联合开发
5月17日,CDE官网显示上海璎黎药业自主研发的创新药PI3Kδ选择性抑制剂林普利司片(代号:YY-20394)上市申请已获得国家药监局受理,用于治疗复发/难治滤泡性淋巴瘤。

04
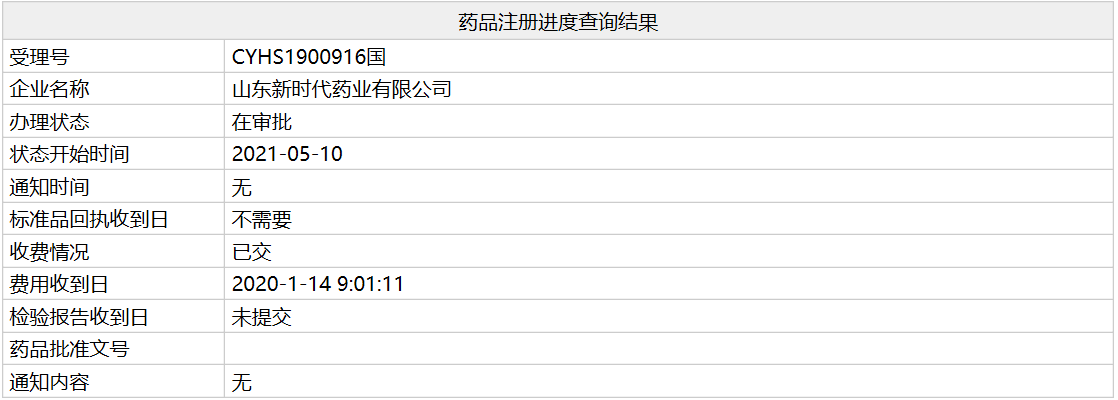
首个「阿昔替尼」仿制药即将获批上市
近日,国家药监局官网显示,山东新时代按4类提交的阿昔替尼(axitinib)仿制药上市申请(受理号:CYHS1900916)已处于“在审批”阶段,即将获得NMPA批准上市,上市后将会是该产品的首仿。
05
阿斯利康申报GLP-1/GCG双靶点激动剂
5月14日,阿斯利康GLP-1R/GCGR双靶点激动剂Cotadutide的临床实验申请获得NMPA受理。Cotadutide为口服多肽制剂,2020年8月公布2b期临床数据,相对于利拉鲁肽,减重和降糖效果更加显著。不过,由于Cotadutide胃肠道副作用显著高于利拉鲁肽,业界质疑减重效果是否与副作用相关。

06
迈威生物申报首个双抗:PD-L1/CD47
5月14日,迈威生物PD-L1/CD47双抗的临床实验申请获得NMPA受理,为迈威生物首个双抗新药。

07
百时美施贵宝申报PD-1/LAG-3抗体鸡尾酒
5月14日,百时美施贵宝PD-1抗体/LAG-3抗体复方制剂的临床试验申请获得NMPA受理。

08
友芝友生物PD-L1/TGF-β双抗获批临床
5月17日,友芝友生物自主研发的“重组抗PD-L1和TGF-β双特异性抗体注射液”(代号:Y101D),获得国家药品监督管理局(NMPA)临床试验默示许可,开展针对局部晚期或转移性肿瘤的临床研究。这是友芝友生物继M802、M701和Y150之后,获得NMPA批准开展临床的第四个双特异抗体新药。此前,该产品已于2021年1月23日获得美国FDA临床试验批准。

09
新码生物引进的创新ADC拟纳入突破性治疗品种,针对HER2阳性乳腺癌
5月18日,中国国家药监局药品审评中心(CDE)最新公示,由浙江医药和其子公司新码生物申报的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)拟纳入突破性治疗品种,拟定适应症为:HER2阳性晚期乳腺癌二线治疗。值得一提的是,该产品已经在今年初获得FDA授予快速通道资格,作为单药用于已接受过一种或多种抗HER2治疗的晚期或转移性HER2阳性乳腺癌患者。
10
旨在功能性治愈乙肝,创新双特异性免疫疗法首个人体试验启动
5月18日,Immunocore公司宣布,在研创新双特异性免疫疗法IMC-I109V,在治疗慢性乙肝(CHB)患者的临床试验中完成首例患者给药。IMC-I109V是Immunocore公司开发的一款双特异性T细胞受体(TCR)疗法。它通过激活T细胞,特异性消灭受到乙肝病毒(HBV)感染,表达乙肝表面抗原(HBsAg)的肝细胞,实现慢性HBV感染者的功能性治愈。
11
美国FDA正式受理信达生物PD-1的上市申请
5月18日,信达生物发布公告,美国食品药品监督管理局(FDA)已经正式受理信迪利单抗注射液新药上市申请 (BLA),用于治疗非鳞状非小细胞肺癌(NSCLC)。本次是信迪利单抗在美国的首个新药上市申请。
12
ImmunityBio冷冻保存的NK细胞疗法获得美国FDA授权,即将启动1期临床研究
近日,临床阶段免疫疗法公司ImmunityBio,Inc.宣布,已经获得美国FDA授权,可以进行一项1期临床研究以评估m-ceNK™平台结合其IL-15超激动剂Anktiva(N-803)用于患有局部晚期或转移性实体瘤患者的安全性和初步有效性。m-ceNK™(memory cytokine-enriched Natural Killer)是一种冷冻保存的富含细胞因子的自体NK细胞治疗,同时IFN-γ表达增加,具有识别和杀死肿瘤细胞的能力。
13
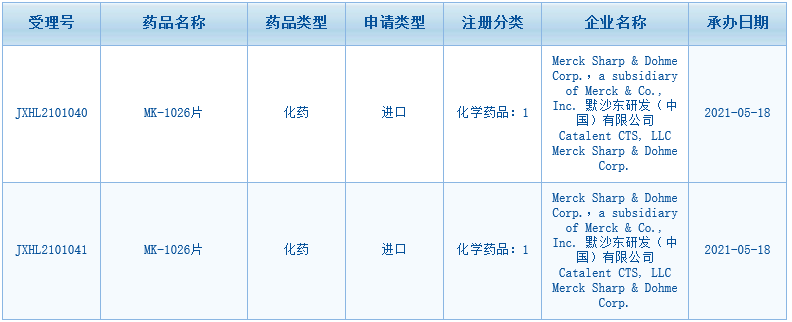
克服BTK耐药,默沙东BTK-C481S抑制剂申报临床
5月18日CDE官网显示,默沙东MK-1026片临床申请获国家药监局受理。是国内第3款申报临床的BTK-C481S抑制剂。
14
诺诚健华自研新型TYK2抑制剂ICP-332获批临床
5月18日,诺诚健华宣布收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,公司自主研发的新型酪氨酸激酶2(Tyrosine Kinase 2, TYK2)抑制剂ICP-332已获批开展临床试验,这也是诺诚健华第五款进入临床阶段的创新药。
15
康方生物CD47单抗骨髓增生异常综合症I/II期研究申请获许可
5月18日,康方生物发布公告,其研发的CD47单抗(AK117)获NMPA批准开展治疗中高危骨髓增生异常综合症(MDS)的I/II期临床研究。
16
开拓药业普克鲁胺获FDA批准开展治疗住院新冠患者III期临床研究
5月18日,开拓药业发布公告,美国食品和药物管理局(FDA)已同意普克鲁胺用于治疗住院新冠(COVID-19)患者的III期临床试验,该试验将同时招募男女性患者。这是开拓药业继普克鲁胺用于治疗轻中症COVID-19患者的III期临床试验之后第2个获得FDA同意的关键性全球多中心III期临床试验。同时,FDA亦已同意在轻中症COVID-19 III期临床试验中拓展纳入女性患者。
17
FDA批准的首款EZH2抑制剂在华申报临床
5月19日,CDE官网显示Epizyme公司Tazemetostat(他折司他)临床申请已获国家药监局受理,是国内第3家申报临床的EZH2抑制剂。

18
祝贺!奕拓医药SHP2变构抑制剂获FDA临床许可
5月19日,专注于开发“不可靶向“药物靶点领域的奕拓医药(Etern Therapeutics)宣布,其创新小分子抗肿瘤药ET0038获得美国FDA新药临床试验(IND)许可。ET0038是奕拓医药自主研发的、具有全球知识产权的SHP2变构抑制剂,拟用于晚期实体肿瘤的临床研究。同期,该在研药物在中国的临床试验申请已获得中国国家药品监督管理局(NMPA)受理。这意味着该产品的临床试验有望很快在中国、美国同步开展。
19
十余年来首款!安进「依特卡肽」在中国递交新药上市申请
5月18日,中国国家药监局药品审评中心(CDE)公示,安进(Amgen)已在中国申报新药盐酸依特卡肽注射液的上市申请,并已获得CDE受理。公开资料显示,依特卡肽(etelcalcetide,英文商品名Parsabiv)是一种新颖的拟钙剂,已于2017年在美国获批用于治疗继发性甲状旁腺功能亢进症(SHPT),针对那些接受血液透析治疗的成人慢性肾脏疾病(CKD)患者,这一批准使得依特卡肽成为十余年来首个被批准用于治疗这种疾病的疗法。
20
百济神州BTK抑制剂新适应症上市申请获FDA受理
5月19日,百济神州宣布,美国FDA已受理其布鲁顿氏酪氨酸激酶(BTK)抑制剂泽布替尼(zanubrutinib)用于治疗先前接受过至少一项CD20导向疗法的成年边缘区淋巴瘤(MZL)患者的新适应症上市申请,并授予其优先审评资格。处方药申报者付费法案(PDUFA)日期为2021年9月19日。
21
驯鹿医疗全人源CD19/CD22双靶点CAR-T产品临床试验申请已获受理
5月19日,驯鹿医疗宣布其自主研发的全人源抗CD19-CD22自体T细胞注射液(研发代号:CT120)的临床试验申请,已获得国家药品监督管理局药品审评中心受理,适应症为CD19/CD22阳性的复发/难治性急性B淋巴细胞白血病(B-ALL)。CT120是驯鹿医疗的第2款重磅CAR-T治疗药物,标志着公司在新一代CAR-T细胞药物开发中迈出了坚实的一步,即将进入临床开发阶段。
22
小分子PD-L1抑制剂!阿诺医药向FDA递交新药临床申请
5月20日,阿诺医药宣布已向美国FDA递交了其原创新药口服PD-L1抑制剂AN4005的临床试验申请(IND)。阿诺医药将开展此药物安全性和药代动力学评估的临床1期试验,患者入组也将于美国启动。
23
FDA受理Alagille综合征药物新药申请并授予优先审评
Mirum制药公司前不久宣布,FDA已受理其用于治疗1岁及以上Alagille综合征(Alagille syndrome,ALGS)患者胆汁淤积性瘙痒的口服依赖性胆酸转运蛋白(ASBT)抑制剂maralixibat的新药申请(NDA),并获得优先审评资格。ALGS是一种罕见的肝病,目前尚无批准的治疗方法。Mirum于2021年1月完成了NDA滚动提交,FDA将在2021年9月29日给出最终决定。FDA将优先审评资格授予那些,相比标准治疗,获批后在治疗,诊断,或预防严重疾病的有效性和安全性上有显著改善的药物。FDA目前不打算召开咨询委员会。
24
STAT5抑制剂获准进入临床试验,治疗新冠疾病
5月21日,据健艾仕生物(GenEros BioPharma)透露,该公司的创新STAT5抑制剂clinflamozyde已获美国FDA批准进入临床试验,用于新冠疾病的治疗。
25
5项3期临床试验全部达标,双重机制糖尿病疗法今年有望递交上市申请
5月20日,礼来(Eli Lilly and Company)宣布,其葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂tirzepatide,在名为SURPASS-4的临床试验中达到主要终点与所有关键性次要终点。与活性对照组相比,在心血管(CV)风险增加的2型糖尿病成人患者中,三种不同剂量tirzepatide均显著降低患者的糖化血红蛋白(A1C)和体重。接受最高剂量(15 mg)的患者组,在治疗52周后,tirzepatide成功使43%患者A1C达到正常人水平,平均体重减少11.7公斤。至此,tirzepatide已在全部5项全球性3期临床试验中达到主要终点。
26
“无癌生存”期翻倍!重磅免疫疗法获FDA批准辅助治疗食管癌
5月21日,百时美施贵宝(BMS)宣布,美国FDA已批准Opdivo (nivolumab)扩展适应症,作为辅助疗法,用于治疗接受完全切除手术的食管癌或胃食管连接部(GEJ)癌患者。这些患者在接受过新辅助放化疗(CRT)后发现残余病理学疾病。新闻稿指出,Opdivo是首款获批辅助治疗这一患者群的免疫疗法。

ASGCT 2021:NK和gdT细胞治疗艾滋病显示出积极结果
近日,在美国基因与细胞治疗年会(ASGCT)上,Seraph研究所(Seraph Research Institute)报告了一项新的研究,提示了治疗HIV的新希望。
该报告介绍了一名54岁感染了HIV的男性患者,患者在在抗逆转录病毒疗法(ART)的作用下并未实现完全抑制,当患者接受了NK细胞和gdT细胞(gamma delta T-cells)的新型过继性细胞治疗后,表现出令人鼓舞的结果。这些治疗性细胞是源自于健康捐赠者。
100%完全缓解率!“连环杀手”CD19 CAR-T公布早期临床数据
近日,Autolus Therapeutics宣布其CD19 CAR-T产品AUTO1在一项用于复发难治惰性非霍奇金淋巴瘤(r/r IBCL)成人患者的临床研究中达到100%完全缓解率。消息公布后,该公司股票大涨35%。
ASGCT 2021:同种异体CD30-CAR病毒特异性T细胞公布早期临床数据
近日,在2021年第24届美国基因与细胞治疗年会(ASGCT 2021)上,Tessa Therapeutics公布了其候选产品TT11X的早期临床结果,TT11X针对CD30阳性淋巴瘤患者显示出早期积极的安全性和有效性。
Biogen 眼科疾病基因疗法 II/III 期临床研究失败
5月14日,Biogen宣布代号为XIRIUS的II/III期临床研究未达到主要临床终点。该研究旨在评估基因疗法cotoretigene toliparvovec(BIIB112)一次性治疗x-连锁视网膜色素变性(XLRP)患者的疗效。
开发进度新突破!德琪医药完成PD-L1/4-1BB双抗定量系统药理学建模,推动I期临床启动
5月17日,德琪医药宣布公司正在开发的新型PD-L1/4-1BB双特异性抗体ATG-101已完成定量系统药理学(Quantitative and Systems Pharmacology, QSP)建模,该模型将指导ATG-101首次人体试验的设计与开展。德琪医药计划于2021年年中在澳大利亚提交ATG-101的首次人体(FIH)临床试验申请,随后将在美国和中国提交临床试验申请。
赛诺菲/GSK重组蛋白新冠疫苗即将进入3期临床试验
5月17日,赛诺菲(Sanofi)和葛兰素史克(GSK)联合宣布,其联合研发的基于重组蛋白的新冠候选疫苗(含佐剂),在共入组722名志愿者的2期临床试验中获得积极结果。在所有成人年龄组中均获得了较强的中和抗体应答,中和抗体水平与COVID-19康复患者水平相当。该疫苗的全球关键性3期临床试验预计将在未来几周开始。
外用JAK抑制剂达到3期临床终点,显著恢复白癜风患者皮肤颜色
罗氏特发性肺纤维化药物Esbriet治疗HFpEF患者二期临床结果积极
近日,美国心脏病学会第70届年度科学会议(ACC.21)上公布了一个发现,一种针对特发性肺纤维化(IPF)的疗法——罗氏Esbriet(pirfenidone,吡非尼酮),在一项由研究者赞助的2期PIROUETTE研究中显示出了希望。
慢性肾病患者福音,IL-6抑制剂有望降低心血管事件风险
5月17日,在美国心脏病学会(American College of Cardiology)第70届年度科学会议上,诺和诺德(Novo Nordisk)公布了在研白细胞介素-6(IL-6)抑制剂ziltivekimab的2期临床试验结果。试验结果表明,ziltivekimab在具有高心血管风险的慢性肾病患者中,显著降低患者与动脉粥样硬化相关的多种炎症生物标志物的水平。试验数据同时在《柳叶刀》上发表。
DMD基因疗法最新临床试验结果积极,有望启动3期临床试验
5月18日, Sarepta Therapeutics展示了其在研基因疗法SRP-9001的最新临床试验结果。SRP-9001通过将编码微抗肌萎缩蛋白(micro-dystrophin)的转基因递送至肌肉组织,从而让肌肉细胞产生微抗肌萎缩蛋白,治疗杜氏肌营养不良症(DMD)。试验结果证明这种疗法能有效升高人体内抗肌萎缩蛋白的表达水平,且安全性与耐受性良好。
无进展生存期翻倍!LAG-3组合疗法2/3期临床结果积极
5月19日,百时美施贵宝(BMS)公布其2/3期RELATIVITY-047临床试验的结果。该试验表明,固定剂量抗LAG-3抗体relatlimab和抗PD-1抗体Opdivo(nivolumab)组合疗法与Opdivo单药相比,在既往未经治疗的转移性或不可切除的黑色素瘤患者中表现出具有统计学意义和临床意义的无进展生存期(PFS)获益。

01
Cell | PP2A-Integrator-CDK9轴调控基因转录过程,可用于癌症的靶向治疗

基因表达的时空调控对于机体发育以及对内在和外在刺激的响应都至关重要。在大多数基因的转录过程中,转录起始后,RNAPII在转录60-100bp后停止,在DSIF和NELF作用下形成“暂停”构象。暂停的RNAPII仍然参与转录过程,只是由于移动功能的减少和结合NTP受损而无法进入延伸状态。随后,P-TEFb(由CDK9和cyclin T1组成)可动态磷酸化RNAPII的C端结构域(CTD)、NELF、DSIF,帮助暂停的RNAPII转变进入活跃的延伸状态。而转录因子c-MYC、BRD4和SEC等可招募P-TEFb到转录暂停位点。
目前的研究多聚焦于RNAPII-CTD激酶,如转录激酶CDK7-CDK9和CDK11-CDK13,对于靶向RNAPII-CTD的磷酸酶则研究较少。近期发现一组磷酸酶可在哺乳动物和较低生物体内去磷酸化RNAPII-CTD,对于RNAPII的循环非常重要。例如,CDK9可介导DSIF组分SPT5的磷酸化,而PP1和PP4分别在DSIF从转录延伸向转录终止和启动子附近区域对SPT5进行去磷酸化。这说明激酶和磷酸酶之间具有功能上的相互作用,从而动态调控核心转录机器。CDK9的小分子抑制剂可抑制转录延伸,导致低磷酸化的RNAPII在转录暂停位点聚集,抑制转录过程。癌症中转录过程发生失调,CDK9抑制剂可用于癌症治疗。那么,激酶和磷酸酶之间的互作是否会影响CDK9抑制剂的抗肿瘤功能?
2021年5月17日,来自澳大利亚Peter MacCallum癌症中心的Ricky W. Johnstone 和美国威斯塔研究所的Alessandro Gardini合作在Cell杂志上发表题为The PP2A-Integrator-CDK9 axis fine-tunes transcription and can be targeted therapeutically in cancer 的文章,发现PP2A复合物通过整合子复合物亚基INTS6招募到转录位点,PP2A动态拮抗CDK9对其底物——DSIF和RNAPII-CTD的磷酸化,在功能上抵抗CDK9介导的RNAPII驱动的转录过程。敲除整合子组分INTS6可抑制CDK9i诱导的肿瘤细胞死亡,诱导转录延伸,以及急性致癌转录反应的扩增。药物激活PP2A可协同CDK9抑制剂杀死白血病和实体瘤细胞,提高体内的治疗效果。
更多解读:
为了探索拮抗CDK9激酶活性的分子,研究人员利用CRISPR技术对CDK9抑制剂(CDK9i)处理的肿瘤细胞进行筛选,检测指标有长期的细胞生存状态和nascent RNA转录水平。综合分析后发现,靶向整合子复合物亚基INTS6导致细胞对CDK9i具有耐药性。敲除INTS6显著提高CDK9i处理细胞的生长竞争优势,减少CDK9i诱导的凋亡,这种现象在多种肿瘤细胞和果蝇细胞系中得到验证,同时研究显示这种现象与整合子复合物的破坏、脱靶效应或其他CDK的活性等无关。探究INTS6/整合子的相互作用蛋白,发现INTS6与其他13种整合子复合物成员、RNAPII核心亚基、PP2A磷酸酶复合物亚基PPP2R1A/PPP2R1B和PP2A-C/PPP2CB具有相互作用。敲低INTS6或INTS8导致PP2A-C和整合子复合物、RNAPII的互作降低,而敲低INTS5或INTS12则不影响。缺失INTS6或INTS8并不影响整合子复合物的催化活性或结构完整性。即INTS6和INTS8是整合子复合物的一部分,可介导PP2A的招募,而这在结构和功能上都不同于整合子INTS4/9/11的催化功能。
那么PP2A被招募到哪里?PP2A、BRD4、RNAPII、CDK9、INTS6、INTS11都位于转录起始点(TSS)区域;CDK9i处理导致RNAPII、BRD4、INTS11在TSS区域累积,而INTS6则略微减少。LPS和EGF急性刺激下,RNAPII、RRR2R1A在TSS和基因主体上招募增加,同时伴随着转录的增加。敲除INTS6或INTS8则导致PPP2R1A结合减少,PPP2R1A和PP2A-C的蛋白水平不变。即PP2A与P-TEFb、整合子在基因组上共定位,其动态的招募依赖于INTS6和INTS8。分析蛋白磷酸化水平,发现CDK9i导致多种蛋白磷酸化水平发生改变,而INTS6缺失导致这些蛋白对CDK9i产生耐药,包括重要的CDK9底物SPT5、RNAPII-CTD、LEO1等。体外系统证明,CDK9和RNAPII-CTD的孵育导致CTD的高磷酸化,而添加PP2A显著减少CTD的磷酸化水平。同时底物的出现导致CDK9激酶活性增加,CDK9抑制剂可抑制CDK9激酶活性,而添加PP2A不影响;CDK9磷酸化的CTD可被PP2A去磷酸化,说明PP2A直接作用于CTD。暂停系数是衡量RNAPII暂停程度的指标,计算分析发现无论是静息状态,还是急性刺激诱导转录状态,CDK9i处理导致转录减少,暂停的释放过程受阻,而敲除INTS6/PP2A则增加RNAPII在基因主体和转录结束位点的分布,减少RNAPII在TSS的积累,即缓解了CDK9i诱导的转录延伸阻断。因此,在急性刺激条件(如EGF和LPS)下,INTS6或PPP2R1A的缺失导致RNAPII在相应基因的基因主体和3’端显著增加,基因表达增加。
最后,研究人员发现PP2A激活剂和CDK9抑制剂联用可显著增加CDK9i诱导的细胞死亡,而缺失INTS6则协同作用消失。这种协同作用在转录水平表现为RNAPII暂停的增加,而PP2A激活剂单独对RNAPII暂停作用较小。白血病和实体瘤小鼠模型中,两者联用显著抑制肿瘤生长,延长小鼠生存期。
总的来说,研究发现整合子亚基INTS6、INTS8和磷酸酶PP2A形成一个调节模块,其功能和结构都与整合子复合物不同,被招募到活跃转录的基因上中和CDK9的活性,从而控制CDK9底物RNAPII-CTD、DSIF的磷酸化水平,调控基因转录。同时CDK9抑制剂和PP2A激活剂联用显著增强CDK9i的抗肿瘤活性,或提供了一种新的肿瘤治疗思路。
原文检索:The PP2A-Integrator-CDK9 axis fine-tunes transcription and can be targeted therapeutically in cancer
02
Immunity | Zeb2基因的全新增强子及其在不同造血阶段中的调控机制

造血过程(Hematopoiesis)是指由造血干细胞(Hematopoietic stem cells, HSCs)及其他前体细胞分化派生出整个血细胞系统的过程。哺乳动物的造血大致分为胚胎造血 (Embryonic hematopoiesis) 和成体造血 (Adult hematopoiesis )两个阶段。早期的胚胎造血只能分化出血红细胞和巨噬细胞等有限的几个群系,而源自HSC的成体造血则几乎可以分化出血细胞系统中的所有群系。HSC和前体细胞的分化受到细胞内基因表达水平的严格调控,而转录因子(Transcription factors, TFs)则通过结合DNA序列上的增强子(Enhancer)来直接控制基因表达。不同群系的细胞中增强子活性不一,最终导致群系特异性的基因表达和细胞的定向分化。那么,同一个基因在不同的造血阶段中会不会被不同的增强子调控?这一问题人们尚无法给出明确解答。
Zeb2基因对造血过程和免疫系统的发育与功能至关重要。HSC分化成为浆细胞样树突状细胞(Plasmacytoid dendritic cells, pDCs)、单核细胞 (Monocytes)以及B淋巴细胞的过程都需要Zeb2的表达。而自然杀伤细胞(Natural killer cells, NK cells)和T淋巴细胞的终端分化和成熟也需要这一基因。但是迄今为止,人们尚不清楚这样一个对多个免疫细胞群系至关重要的基因,在免疫细胞的分化过程中是被哪些增强子调控的。
2021年5月17日,圣路易斯华盛顿大学医学院的Kenneth M. Murphy团队(第一作者为黄晓博士)在Immunity杂志上发表了题为Differential usage of transcriptional repressor Zeb2 enhancers distinguishes adult and embryonic hematopoiesis 的研究论文。此文中,作者首次发现了Zeb2基因的两个增强子;并阐述了在胚胎造血过程中和成体造血过程中,这两个增强子被差异性使用以调控Zeb2基因表达的分子机制 (图1)。
更多解读:
作者团队2019年发表于Nature Immunology杂志上的论文中,首次发现了由Nfil3,Id2和Zeb2三个基因构成的转录调节回路。在这个回路中Nfil3和Id2通过调节Zeb2的表达水平来控制树突状细胞(Dendritic cells, DCs)前体细胞的分化。然而,ID2蛋白并不能直接结合Zeb2序列上的增强子,这意味着ID2对Zeb2基因的调控是间接的,而ID2的靶点——E-蛋白转录因子家族 (E-proteins family transcription factors)很可能在造血过程中直接结合Zeb2的增强子并调控其表达。
在2021年发表的论文中,为了进一步研究Zeb2表达调控的分子机制,作者首先分析了已发表的染色体免疫共沉淀测序(ChIP-seq)数据,并发现位于Zeb2基因转录起始点(Transcription start site,TSS)上游165kb的增强子(-165kb enhancer)可以结合E-蛋白。基于CRISPR技术的体外基因编辑实验显示,在小鼠基因组上删除-165kb增强子可以阻止从小鼠骨髓中提取的前体细胞发育成为pDC。这意味着Zeb2在DC前体细胞中的表达需要完整的-165kb增强子。
为了进一步研究-165kb增强子在体内的功能,作者利用CRISPR基因编辑技术建立了缺失-165kb增强子的小鼠模型(Zeb2Δ-165 小鼠)。与野生型(Wild type, WT)小鼠相比,Zeb2Δ-165小鼠完全丧失了pDC和单核细胞发育的能力,同时B细胞的数量大幅下降。事实上,在Zeb2Δ-165 小鼠的HSC内完全检测不到Zeb2的表达水平,而WT小鼠中HSC则表达中等水平的ZEB2蛋白。这表明源自HSC的成体造血过程中,Zeb2基因的表达都受到-165kb增强子的调控。
尽管单核细胞的发育在Zeb2Δ-165 小鼠中完全消失,与单核细胞关系紧密的组织驻留型巨噬细胞(Tissue resident macrophage, RTM)的发育却并未受到影响。成年小鼠体内的RTM多数来自胚胎造血,由卵黄囊中的巨噬细胞(Yolk sac macrophages)和胚胎肝单核细胞 (Fetal liver monocytes) 发育而成。在成体小鼠中,在某些特殊条件下,血液中由HSC发育而成的单核细胞也可以分化成RT】。以往研究表明,RTM的功能及发育也需要Zeb2。作者对脾脏内的RTM进行了Zeb2 mRNA的逆转录定量PCR(qRT-pCR)分析,并发现Zeb2Δ-165 小鼠脾脏RTM内的Zeb2 mRNA水平与WT小鼠并无显著差异。这些数据证明Zeb2Δ-165 小鼠体内的RTM并不是在成体造血过程中由HSC发育而成的,且-165kb增强子对Zeb2基因在这些细胞中的表达也不必要。
为了进一步探究Zeb2在巨噬细胞内的调控机制,作者对早期造血过程中的卵黄囊巨噬细胞和胚胎肝单核细胞进行了分析。Zeb2Δ-165 小鼠的卵黄囊巨噬细胞发育完全正常,胚胎肝单核细胞虽然相比WT小鼠有所减少,但是其ZEB2蛋白表达水平与WT小鼠并无显著差异。这表明,在胚胎造血过程中,Zeb2基因的表达是由-165kb增强子以外的一个增强子驱动的。为了找到这个增强子,作者对来自胚胎和成体的巨噬细胞和单核细胞进行了染色质开放性测序分析(ATAC-seq)。数据表明,-165kb增强子在上述几个群系中均具有活性,但是一个位于Zeb2基因TSS下游164kb的增强子(+164kb enhancer)则只在卵黄囊巨噬细胞和胚胎肝单核细胞中具有活性,在由HSC发育而成的成体单核细胞内则没有活性。同时,对一些在胚胎巨噬细胞和单核细胞内特异性表达的转录因子(如NUR77和LXRα)的ChIP-seq分析也表明这些转录因子可以结合在+164kb增强子上。这些结果提示,很有可能正是这些只在胚胎巨噬细胞和单核细胞内表达,而不在成体单核细胞内表达的转录因子结合在+164kb增强子上,并驱动了胚胎细胞内Zeb2基因的表达,使得在这些细胞内,即使-165kb增强子缺失,Zeb2也可以正常表达。
最后,为了进一步研究-165kb增强子调控Zeb2表达的分子机制,作者对WT和Zeb2Δ-165 小鼠的脾脏巨噬细胞进行了Hi-C分析。Hi-C实验可以获得细胞内染色质的3D结构。数据表明,Zeb2基因的启动子(Promoter)与-165kb增强子和+164kb增强子之间都有相互作用,而删除-165kb增强子后,Zeb2的启动子与上游大量增强子之间的相互作用大大减少,却并不影响其与下游+164kb增强子之间的作用。这表明-165kb增强子对维护Zeb2基因上游染色质结构至关重要。
综上所述,作者利用基因编辑小鼠模型和一系列高通量测序的实验手段,发现了调控Zeb2基因的两个增强子,其中+164kb增强子可能在胚胎造血过程中调控Zeb2表达,而-165kb增强子则在成体造血过程中支持Zeb2的表达。-165kb增强子对于免疫细胞的分化有着不可或缺的作用。
原文检索:Differential usage of transcriptional repressor Zeb2 enhancers distinguishes adult and embryonic hematopoiesis
03
Nature+NBT | 单碱基编辑在非人灵长类动物中的首次应用:靶向PCSK9基因预防心血管疾病

CRISPR-Cas9/Cas12为代表的基因编辑技术正成为疾病治疗的热门策略。这其中可实现A·T--G·C碱基对转换的新型单碱基编辑器ABE(Adenine Base Editor)的出现,让高效精准的基因编辑成为可能,也成为多种疾病治疗的热门工具。虽然ABE工具已在小鼠疾病模型的治疗研究中取得众多成果,但其在非人灵长类动物模型中的递送效率和治疗效果依然缺少研究,这也限制了单碱基编辑技术在临床治疗中的应用。
2021年5月19日,来自美国Verve Therapeutics公司的Sekar Kathiresan团队在Nature发表题为In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates 的论文。文章利用单碱基编辑工具ABE和脂质纳米颗粒(LNPs)在非人灵长类模型中实现了PCSK9基因剪接位点的精准编辑。研究指出,该策略只需单次注射便可持久抑制肝脏中PCSK9基因的表达,最终有效降低血液中PCSK9和低密度脂蛋白的水平。本研究为心血管疾病的预防提供了全新的思路。
更多解读:
研究者选择单碱基编辑工具ABE8.8用于PCSK9基因剪接位点的精准编辑以实现PCSK9表达的持久抑制。根据ABE8.8的活性窗口和PCSK9剪接受体/供体位点的序列特征,研究者设计出20种PAM序列为NGG的gRNAs。随后研究者通过LNPs转染ABE8.8 mRNA/gRNA的方式在人原代肝细胞中筛选最优gRNA。结果显示,靶向PCSK9基因1号外显子剪接供体的PCSK9-1 gRNA效果最佳,编辑效率可达60%。由于PCSK9-1 gRNA的靶位点在人与食蟹猴基因组中高度保守,研究者在食蟹猴原代肝细胞中进一步证实了PCSK9-1 gRNA的有效性。此外,小鼠Pcsk9基因在该位点具有高度的同源性,也存在适合ABE8.8的gRNA PCSK9-1m(与PCSK9-1存在4碱基错配)。因此研究者利用LNPs和ABE8.8 mRNA/ PCSK9-1m gRNA,通过静脉注射的方式在小鼠体内验证该策略的有效性。结果显示注射一周后,小鼠肝脏中靶位点的编辑效率可达70%。
之后研究者在食蟹猴中对LNPs和ABE8.8 mRNA/PCSK9-1 gRNA的编辑效果进行更系统的检验。预实验结果显示,以1.0 mg/kg的剂量注射LNPs两周后,食蟹猴肝脏中PCSK9靶位点的编辑效率可达63%。与此同时,血液中PCSK9蛋白也降低了81%,低密度脂蛋白(LDL)胆固醇水平也降低了65%,这表明LNPs和ABE8.8 mRNA/PCSK9-1 gRNA可实现食蟹猴肝脏中PCSK9靶位点的高效精准编辑并具有潜在的治疗意义。研究者还指出,该策略具有明显的组织特异性:其在肝脏中的编辑效果最为明显,此外仅脾脏和肾上腺中有低水平的编辑效果。随后的剂量效应实验发现,LNPs在0.5、1.0和1.5 mg/kg的剂量下对PCSK9靶位点的编辑效率均>50%,且剂量≥1.0 mg/kg时,编辑效率、PCSK9和LDL胆固醇的降低均趋于饱和。此外,LNPs注射会导致食蟹猴肝脏功能指标AST和ALT的短时中度上升,但一周后便可恢复正常。研究还发现,大部分的LNPs组分在食蟹猴循环系统中存留的时间不超过两周,而ABE8.8 mRNA/PCSK9-1 gRNA在注射后48小时后便快速降解,一周后便被清除干净。
随后研究者还开展了一项持续至今的长期研究,以3.0 mg/kg的LNPs剂量检验食蟹猴对单碱基编辑的药物耐受性,以及PCSK9基因编辑后PCSK9和LDL胆固醇水平降低的持久性。结果显示,LNPs注射1周后,血液中PCSK9水平便可降低近90%,血液中LDL胆固醇和脂蛋白的水平则分别降低60%和35%,且这种降低可持续至少8个月。长期研究还指出,LNPs注射后,AST和ALT会有瞬时中度上升,但两周后便可恢复正常。除此之外,实验中的食蟹猴并无其它肝功能异常和健康异常。
已知单碱基编辑工具在DNA水平和RNA水平可能存在不同程度的脱靶风险。为此,研究者首先在食蟹猴原代肝细胞和肝脏组织样本中对LNPs和ABE8.8 mRNA/PCSK9-1 gRNA在DNA水平的脱靶效应进行分析。借助于新的脱靶分析策略ONE-seq,研究者共发现48处潜在的脱靶位点,定向PCR扩增测序结果显示,肝细胞和肝脏组织中的脱靶效应相似,且仅1处位点有较明显的脱靶效应但脱靶位点的编辑效率<1%。随后研究者还通过ONE-seq和Digenome-seq两种脱靶分析策略在4种不同供体来源的人原代肝细胞中分析脱靶效应,结果显示两种策略发现的数十处脱靶位点均无明显的脱靶效应。研究者还对该策略在RNA水平的脱靶效应进行分析,结果发现其在RNA水平并无明显的脱靶效应。以上结果表明,非人灵长类动物中,通过LNPs递送的ABE单碱基编辑有较高的安全性。
此外,来自瑞士苏黎世大学的Gerald Schwank实验室与荷兰玛西玛公主小儿肿瘤中心的Sean C. Semple实验室合作,在Nature Biotechnology杂志发表In vivo adenine base editing of PCSK9 in macaques reduces LDL cholesterol levels的文章,该研究的策略与Nature文章类似,借助于脂质纳米颗粒递送的ABE系统,研究者在小鼠和非人灵长类动物中成功实现了肝脏组织中PCSK9基因的精准编辑,最终有效降低了血液中PCSK9和LDL蛋白的含量,这为未来肝脏疾病治疗提供了新思路。
总体而言,两项研究均表明,利用脂质纳米颗粒LNPs递送单碱基编辑工具ABE可实现非人灵长类动物肝脏中PCSK9基因的高效精准编辑,而且只需单次注射便可实现血液中PCSK9和LDL胆固醇的持久降低,这为心血管疾病的预防和治疗提供了全新的思路。这是研究者首次在非人灵长类动物体内开展单碱基编辑治疗的研究,具有非常重要的指导意义,将极大的推动单碱基编辑技术的临床转化应用。
原文检索:In vivo CRISPR base editing of PCSK9 durably lowers cholesterol in primates
04
eLife 丨赵永娟团队在神经轴突变性蛋白SARM1探针和抑制剂开发中取得昕进展

神经元是大脑中非常重要的功能单位,它们具有很独特的树状细胞结构,通过树突和轴突传递化学信号和电信号,使我们可以感知世界、运动、思考、记忆、爱憎……使我们得以为“人”。随着年龄增长,在遗传和环境因素的共同作用下,一些神经元开始死亡,导致了自然的机能衰退,严重的功能障碍形成了神经退行性疾病,如阿尔兹海默症、帕金森病和肌萎缩性脊髓侧索硬化症等。为了治疗这些疾病,或者延缓它们的发生,长期以来,科学家们致力于研究并防治神经元的胞体死亡,默认相同的机制可应用于轴突。直到较为近期,才发现轴突变性是不同的主动程序性死亡过程,该过程伴随着辅酶NAD(烟酰胺腺嘌呤二核苷酸)水平的急剧下降。2012年,在果蝇突变体中筛选到一个基因dSARM,它的突变可以显著延缓轴突变性,该功能进化保守,小鼠和人同源基因SARM1也具有同样的性质。2017年,研究证明SARM1的TIR结构域具有切割NAD的活性。以上两项关键研究提示,SARM1是一个抑制轴突变性的潜在药物靶点。但是目前为止,仍缺乏一个高效的SARM1活性检测方法,很大程度限制了SARM1的作用机理研究和药物开发。
2021年5月3日,香港中文大学(深圳)生命与健康学学院赵永娟课题组在eLife杂志上发表了题为Permeant Fluorescent Probes Visualize the Activation of SARM1 and Uncover an Anti-neurodegenerative Drug Candidate 的文章,研究人员利用SARM1独特的碱基交换特性,设计并筛选了SARM1特异的荧光探针PC6,其灵敏度高于现有探针百倍,特异性强,能够应用于检测体外和细胞内的SARM1活性,及其高通量药物筛选。
更多解读:
研究人员根据电子供体-π-受体的形式设计了多个苯乙烯吡啶偶联物(Pyridine conjugates, PCs),利用吡啶环作为电子受体基团和不同的乙烯基苯环衍生物作为电子供体基团。当发生碱基置换反应时,SARM1催化PC探针替换NAD上的烟酰胺基团,使吡啶环带上正电,增加吸电子能力和分子内电荷转移,导致产物的荧光波长红移。
各种光学特性和特异性使6#探针(PC6)脱颖而出,它可以进入细胞,被催化后在细胞内积累荧光信号,这一特性使之可以用于活细胞成像。研究人员因此得以详细研究SARM1在各种激活条件下的活化,特别是首次在显微镜下对原代神经元轴突损伤后SARM1的活化过程实现了实时成像,揭示该活化早于轴突变性;利用基因编辑技术和激活剂等手段证明SARM1活化是轴突变性的必要不充分条件,它调控轴突变性下游事件的机制仍在探索中。
研究者进一步利用PC6进行了药物筛选,筛选获得的多个SARM1的高效抑制剂,其中抗高血压药尼索地平显示出很好的活性,但是批次之间差异巨大。经过探索,最终证明,是尼索地平的光解产物dHNN(上图中黄色小分子)对SARM1具有独特的抑制活性。它通过共价修饰Cys311,把SARM1固定在八聚体莲花样结构,从而抑制其激活,该结果揭示了有效的别构抑制位点;进一步的,在原代神经元的轴突损伤模型中证明,该化合物可以抑制损伤造成的轴突变性。该项工作将有效推动神经退行性疾病的相关机理研究和药物研发进程。
原文检索:Permeant Fluorescent Probes Visualize the Activation of SARM1 and Uncover an Anti-neurodegenerative Drug Candidate
05
Nat Comm | 沈侠团队取得基因组遗传多效性评估新进展

遗传多效性(Pleiotropy)是有着超过一个多世纪历史的遗传学概念,描述一个DNA变异或基因同时影响多个性状的现象。近十五年,大量的全基因组关联研究(Genome-Wide Association Studies,GWAS)表明人类的复杂性状普遍具有“微效多基因”的遗传图谱——即受许多基因及变异的影响,而每个基因及变异对复杂性状的效应十分微小。从而,基因组中大量的变异普遍具有遗传多效性。那么,对于我们所研究的各种人类性状,哪个变异或基因对我们的影响最大呢?
现有的GWAS结果可以帮助我们回答这一问题,但却并非易事。在综合考虑遗传变异或基因对很多性状的影响时,如何将微小的遗传效应(Genetic Effect)与数据中的噪声(Noise)区别开有很大难度。我们通常可以对GWAS结果根据其统计学显著性人为设定一个阈值,但这样简单的手段并不能有效地区分遗传效应的有无。GWAS是典型的多重检验问题,使用宽松的阈值(如P < 0.05)显然会导致过多的假阳性,而严格的阈值(例如常用的基因组显著性水平P < 5×10−8)则会导致过多的假阴性。然而,若直接舍弃显著性阈值,直接将所有表型的遗传效应直接相加也会引入过多的来自无遗传效应变异的噪声。此外,不同性状之间的相关性也需要被合理地考虑。
2021年5月14日,中山大学生命科学学院沈侠教授团队在 Nature Communications 杂志上发表了题为 Total genetic contribution assessment across the human genome 的论文。该研究开发了一种不依赖统计阈值来估计单个变异总遗传效应的新方法(Total Genetic Contribution Assessment, TGCA),解决了上述困难,并对 UK Biobank 中各类性状进行了全基因组各个变异遗传总效应评估。更多解读:
这项研究中,作者运用混合分布模型对单个遗传变异在多个性状上的遗传效应进行统计建模,将遗传效应分为正遗传效应、无遗传效应、以及负遗传效应三个部分。该模型在区分有无遗传效应的同时,同时考虑了遗传效应影响的广度(即遗传多效性)和遗传效应影响的深度(即遗传效应的大小)。通过对混合分布模型的拟合,作者利用估计得到的正负遗传效应的比例及均值,设计出一个新的总遗传效应统计量(TGCA Θ),并通过大量的模拟计算证明了TGCA方法可以在各种情况下有效地估计总遗传效应。
作者运用TGCA方法评估了全基因组各个遗传变异对UK Biobank中五类复杂性状或疾病的总遗传效应,包括医疗健康情况(122个性状)、体格特征(117个性状)、生活方式(172个性状)、心理健康情况(189个性状)、以及饮食状况(139个性状),提供了全基因组遗传变异对五种类型性状总贡献的图谱。研究发现,人类HLA位点对健康相关性状有最突出的遗传效应,骨密度位点WNT16对体格特征性状有最突出效应,而皮肤着色位点MC1R和吸烟易感位点CHRNA3对生活方式相关性状有突出的遗传效应(图)。
此外,作者通过将遗传变异对各类性状的总遗传效应与GTEx中48个人体组织的基因表达数据进行整合,检验了总遗传效应在组织器官中的富集程度,从而将总遗传效应关联到组织器官水平。例如,研究发现,心理健康相关性状的整体遗传效应在大脑特异表达的基因中富集,而其他类型性状的整体遗传效应在大脑中无显著富集。已有研究表明基因和蛋白质表达的顺式调控元件集中在转录起始位点附近,而这些区域富集了复杂性状的遗传力。作者发现,如果一个特定的组织富集了某一类型性状的总遗传效应,则在这一组织特异表达的基因的顺式调控位点(cis-eQTL)也同样富集这一类型性状的总遗传效应,从而说明总遗传效应与人体组织的关联是由组织特异表达基因的顺式调控元件驱动的。
这一统计遗传学的前沿研究对遗传多效性进行了新的解读,通过开发并运用新的总遗传效应评估方法,分析当今GWAS结果大数据资源,提供了人类遗传变异对多种复杂性状的总遗传效应图谱。新方法能有效挖掘现有数据的更多信息,有望在多组学与基因组结合的数据分析中有重要应用。
原文检索:Total genetic contribution assessment across the human genome
06
Mol Cell丨吕志民团队揭示肿瘤细胞氧化应激调控的新机制

谷氨酰胺是肿瘤细胞生长所必需的氨基酸,可通过以下三种途径促进肿瘤的发生发展:1. 通过分解产生α-酮戊二酸,进入三羧酸循环中代谢而提供能量;2. 提供生物大分子合成所必需的原料;3. 产生还原型谷胱甘肽、NADPH,用以抵抗肿瘤细胞内高水平的活性氧。作为谷氨酰胺分解代谢的第一个酶,谷氨酰胺酶(GLS)主要存在于线粒体内,可以将谷氨酰胺分解为谷氨酸和氨。因其在肿瘤发生发展中的重要作用,GLS被认为是一个有价值的肿瘤治疗靶点,靶向GLS的药物现已进入临床试验。
琥珀酰化修饰是一种新近发现的蛋白翻译后修饰类型,其广泛存在于包括组蛋白在内的多种蛋白中。浙江大学吕志民课题组此前在Nature(2017, PMID: 29211711)发文,首次发现了组蛋白琥珀酰化修饰的转移酶——KAT2A,其可以利用琥珀酰辅酶A作为底物,催化组蛋白H3 K79位点的琥珀酰化,进而促进促癌基因的转录及肿瘤的发生发展。在线粒体内存在大量的代谢酶,这些酶的琥珀酰化修饰的重要性如何?以及琥珀酰化修饰的调控机制是什么?这些问题都有待进一步研究。
2021年5月14日,浙江大学转化医学研究院吕志民教授和中国海洋大学于日磊教授(共同通讯作者)合作在Molecular Cell 上在线发表了题为SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells 的文章。该项研究发现,在胰腺导管腺癌中呈现GLS的高表达,相比于正常细胞,胰腺导管腺癌细胞的生长和存活对于谷氨酰胺代谢表现出更强的依赖性。重要的是,在GLS蛋白上也发现了琥珀酰化修饰,该修饰发生在K311位点,可由琥珀酰辅酶A直接介导。琥珀酰化修饰促进了GLS由单体向有活性的四聚体的转换,从而提高了其催化活性,增强了对谷氨酰胺的分解代谢。
更多解读:
琥珀酰辅酶A合成酶亚基β (succinyl-CoA synthetase ADP-forming subunit β, SUCLA2)是琥珀酰辅酶A合成酶复合体的一个组分,可以将琥珀酰辅酶A分解为琥珀酸和辅酶A。研究发现,SUCLA2可以在线粒体内结合GLS,SUCLA2通过代谢反应降低了GLS周围局部的琥珀酰辅酶A的水平,从而降低了GLS的琥珀酰化修饰水平。而在氧化压力存在的条件下,激活的p38 MAP激酶介导了SUCLA2 S79位点的磷酸化,从而破坏了SUCLA2与GLS的相互作用,使SUCLA2与GLS解离,导致了GLS 周围局部琥珀酰辅酶A水平的升高,进而增加了GLS琥珀酰化修饰,促进了其活性。激活的GLS增加谷氨酰胺分解和还原性物质的产生,从而对抗氧化应激,促进肿瘤细胞存活和肿瘤生长。在临床样本中也发现,SUCLA2 pS79和GLS K311琥珀酰化水平呈正相关,与胰腺导管腺癌患者的临床分期和不良预后呈正相关。
本研究揭示了GLS上的一种新型翻译后修饰——琥珀酰化,对于GLS活性的重要调节作用,并发现肿瘤细胞在氧化应激条件下,通过SUCLA2调控 GLS的琥珀酰化和酶活性,进而增强谷氨酰胺代谢水平。该研究强调了小分子代谢物质(如琥珀酰辅酶A),调控线粒体代谢活动和细胞氧化压力的新型机制,并将为肿瘤治疗新策略的开发提供新思路。
原文检索:SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells
07
Cell | 杜鹏课题组揭示通过抑制剪接体捕获和维持小鼠全能性干细胞

小鼠胚胎发育由合子开始,经过2细胞、4细胞、8细胞和桑椹胚,形成囊胚,之后继续发育形成胚内和胚外组织。具有最高潜能的干细胞被称为全能性干细胞,一般指体内的合子,2/4细胞,它可以发育到胚内和胚外组织。多能性干细胞,一般来源于囊胚的内细胞团,它的发育潜能是受限的,只能发育到胚内组织。1981年,人们首次在体外成功分离了第一株小鼠多能性胚胎干细胞系(ESC)。直到40年后的今天,所有培养的小鼠胚胎干细胞都处于多能状态,人们一直致力于体外建立发育潜能更高的干细胞。表达全能性基因Zscan4s和Mervl的2C-like细胞是最早报道的能够产生胚内和胚外组织的细胞。但是,2C-like细胞在培养基中是亚稳态的,仅以极低的百分比(0.1%-1%)存在。2017年,两个研究小组报道使用不同的化学小分子混合物建立了扩展型多能干细胞(Expanded (or extended) pluripotent stem cell,EPSC),具有胚内和胚外双向分化潜能。但是,这种扩展性多能性干细胞的分子特征和功能等方面和体内真正的全能型胚胎细胞仍存在较大差距。迄今为止,人们无法在体外捕获和维持分子和功能上与体内全能性胚胎相似的全能性干细胞,因此也就无法真正利用体外细胞培养体系研究着床前胚胎发育过程,并且导致胚外组织的体外分化及相关转化医学应用等方面也存在极大的局限性。
2021年5月14日,北京大学杜鹏课题组在Cell杂志在线发表了题为Mouse totipotent stem cells captured and maintained through spliceosomal repression 的研究论文。在这项研究中,作者通过抑制剪接体,实现了小鼠全能性干细胞的体外建立和培养,且这种细胞在分子和功能上接近体内2细胞和4细胞时期胚胎,因此被命名为totipotent blastomere-like cells(TBLCs)。
更多解读:
在本研究工作中,作者主要有以下发现:
1、剪接体抑制驱动多能干细胞到全能干细胞的转变
作者分析了先前发表的单细胞胚胎数据,发现剪接因子在早期胚胎发育中是动态变化的,有一类剪接因子在胚胎发育早期低表达,在后期表达量逐渐升高。作者发现敲低这一类关键剪接因子能广泛激活全能性基因(如Zscan4s,Plk2,Btg1/2以及转座子Mervl和Mt2),沉默多能性基因(如Utf1,Tdgf1,Sox2),将小鼠多能性的ESC重编程为全能性状态。同时,将剪接抑制剂Pladienolide B(PlaB)添加到Serum/ LIF培养基中(SLP培养基),能够在体外培养和维持TBLC,且细胞活性和核型正常。与PSCs (pluripotent stem cells) (P0)相比,在SLP培养基中培养5代之后,整体转录组趋于稳定,特异性表达胚胎时期的全能性基因,沉默囊胚时期特异性表达的多能性标记基因,接近体内胚胎的2细胞和4细胞时期。其次他们发现撤去PlaB后,TBLCs细胞能够转换到多能性状态,说明单个剪接抑制剂PlaB可以操纵这个多能/全能干细胞转换过程。SLP培养条件提供了一个可靠的体外系统来研究全能到多能细胞的转换,且这个系统在分子水平上能够模拟从体内2细胞时期到囊胚时期的发育。
2、TBLC在单细胞转录组、翻译组、DNA甲基化组和染色质可及性上具有与2细胞和4细胞时期相似的分子特征
作者首先对PSCs和TBLCs进行了单细胞转录组测序。使用23个多能性标记基因和30个全能性基因以及转座子Mervl和Mt2,区分了PSC和TBLC,发现几乎所有的TBLC来自SLP培养基,说明SLP培养基能培养和维持TBLC细胞的同质性。此外,翻译组测序(Ribosomal profiling,Ribo- seq)显示,与PSCs相比,TBLCs在翻译组水平上全能性基因表达上调,多能性标记基因表达下调。作者使用全基因组亚硫酸氢盐测序法(Whole-Genome Bisulfite Sequencing,WGBS)来表征PSCs和TBLCs的DNA甲基化组,发现PSCs中的整体甲基化水平为71%,接近E6.5-E7.5时期胚胎;而TBLCs与之相比甲基化水平大幅降低至35%,类似于体内2细胞和4细胞胚胎(整体甲基化程度分别为47%和41%)。染色质可及性测序ATAC-seq(Assay for Transposase-Accessible Chromatin using sequencing)结果显示,与PSCs相比,TBLCs在转录起始位点(TSS)附近的开放峰和封闭峰与小鼠2细胞和4细胞胚胎时期显示出相似的开放或封闭状态,这意味着TBLCs具有与早期胚胎相似的染色质可及性。综上,作者使用单细胞测序以及多组学分析,表征了与体内全能性胚胎相似的TBLCs在转录组,DNA甲基化组,染色质可及性和翻译组上的分子特征。
3、TBLC与EPSCs和2C-like细胞不同,在分子水平上靠近2细胞和4细胞时期胚胎
此外,作者比较了TBLCs与已发表的EPSCs和2C-like细胞的转录组测序数据,发现与TBLCs细胞中大多数多能性标记基因被广泛沉默不同,EPSCs仍明显表达多能性标记基因;而在TBLCs中高表达的全能性基因或转座子在EPSCs中表达量很低。最后,作者对TBLCs和EPSCs与小鼠植入前胚胎数据进行了基于转录组的主成分分析以及与2C-like细胞的相关性分析,发现TBLCs明显靠近2细胞和4细胞时期胚胎,EPSCs和2C-like细胞接近多能性囊胚时期,这与最近一个研究组得到的结论一致。
4、TBLC具有双向分化潜能,能够产生多种胚内和胚外细胞谱系
作者进行的功能嵌合实验表明,TBLC具有强大的双向发育潜能,可以产生胚内和胚外组织,包括囊胚时期的TE,E6.5-E7.5胚胎的EPC和ExE,以及发育后期的胎盘和卵黄囊。更重要的是,作者还观察到来源于单个TBLC的荧光标记细胞可以嵌合进入整个E6.5-E7.5胚胎,包括EPI,ExE和EPC。小鼠胎盘是一个富含血液的复杂器官,为了避免免疫染色产生的假阳性,作者将E13.5嵌合小鼠的胎盘和卵黄囊消化成单细胞,并通过流式富集筛选出有荧光标记的TBLC来源的细胞进行单细胞测序,发现其能够在小鼠体内分化为至少6种胚外和15种胚内细胞类型。本篇文章首次利用单细胞转录组准确追踪出供体细胞的发育谱系,为全能性细胞的功能性检验提供了一个更严格的检验方法。作者使用单细胞测序,证明了TBLC能够在胎盘和卵黄囊中分化为至少6种胚外和15种胚内细胞类型。
最后,作者发现,在小鼠胚胎干细胞中,动态剪接体阻遏导致了广泛的内含子积累,从而导致多能性基因表达下降,而全能性基因仍然可以被有效地剪接并激活,这可能与全能性基因拥有短而少的内含子的独特基因特征有关,但是更详细的机制还需要继续探索。
综上,此项研究首次建立了体外捕获和培养全能性干细胞的方法,而且令人惊奇的发现了揭示了剪接体在干细胞命运转变中的重要决定作用。故此,该成果不但对于早期胚胎发育相关的基础研究提供了新的体外研究体系,同时也为未来干细胞相关的临床医学研究提供了新型的发育潜能极高的“种子细胞”来源。
原文检索:Mouse totipotent stem cells captured and maintained through spliceosomal repression
08
Nature|Juli Feigon/周正洪等合作提出了端粒酶连续延长端粒重复DNA序列的分子机制模型

端粒是位于线性染色体末端由重复DNA序列及保护蛋白构成的复合物。端粒的存在对于保持真核细胞基因组的稳定性和完整性具有重要作用。在成体细胞中,端粒的长度会随着细胞分裂次数的增加而逐渐缩短,最终引发细胞的衰老和死亡。而在胚胎干细胞和癌细胞中,缩短的端粒DNA可以被一种特殊的逆转录酶——端粒酶——延长,从而保持细胞的“永生”。因此,自端粒酶于1985年在四膜虫中被发现以来,其功能和活性调控机制一直是细胞衰老、干细胞和癌症研究的热点。
同其它聚合酶相比,端粒酶的特殊之处在于其催化核心 (catalytic core) 由端粒酶逆转录酶(TERT) 和端粒酶RNA (TER) 两部分共同组成,并且后者携带了合成端粒DNA所需的模板。在DNA的延长过程中,端粒酶需要重复利用该模板实现数十个重复序列的连续合成。每完成一个重复序列的添加,RNA模板会与DNA链分离,移动,并再次配对到该DNA链的末端,从而开启下一轮重复序列的合成 (图1右)。该过程中涉及到的一系列步骤,包括模板移动的起始和终止,RNA/DNA杂交螺旋的形成、稳定和解旋等,都需要端粒酶逆转录酶的高度配合才得以完成。然而长期以来,端粒酶高分辨率结构的缺失严重阻碍了人们对上述步骤分子机制的理解。
加州大学洛杉矶分校 (UCLA) Juli Feigon组和周正洪组多年合作,利用四膜虫端粒酶作为模型,对端粒酶的结构和功能机制进行研究。2021年5月12日,两组合作于Nature在线发表题为Structures of telomerase at several steps of telomere repeat synthesis 的最新研究成果。在这项工作中,研究人员通过加入不同DNA将端粒酶的RNA模板限制在不同位置,并先后解析了模版位于+3 (3.3 Å)、+4 (4.4 Å) 和 +5 (3.8 Å) 三个位置的冷冻电镜结构。
更多解读:
这些结构显示,端粒酶RNA通过与TERT的特异性相互作用对模板的上游和下游进行锚定,两个锚点与模板之间由柔性区域相连。这一结构特性在给予RNA模版活动性的同时,又将其运动范围限制在6个碱基之内。与此同时,TERT独有的TRAP结构域与经典的thumb helix共同构成一个容纳模板下游柔性区域的通道,进而调控RNA模版的运动。通过比较这些结构,作者发现RNA/DNA杂交螺旋的长度并不会随着DNA链的合成而增加,而是始终维持4-5个碱基对。这样的“亚稳态”螺旋被位于TERT上的bridge loop进一步稳定,既保证了DNA的顺利合成,又使得RNA模版可以在一个重复序列合成结束后与DNA链分离。基于上述结构信息,作者设计了一系列位于作用界面上的氨基酸突变,并系统研究了这些突变对于端粒酶活性及连续合成能力的影响。最终,作者提出了一个全新的端粒酶连续合成多个重复DNA 序列的分子机制模型。
除了催化核心外,端粒酶在细胞内的正常功能还需要一系列辅助蛋白的参与。这些蛋白与端粒酶催化核心的相互作用往往只在细胞周期的特定阶段进行,限制了相关结构生物学的研究。得益于四膜虫端粒酶独特的“完整性”,作者在文章里详细描述了辅助蛋白p65与端粒酶RNA,p50与TERT以及Teb1与DNA的相互作用界面,为理解端粒酶的组装、招募以及DNA产物处理等过程的分子机制提供了结构基础。
原文检索:Structures of telomerase at several steps of telomere repeat synthesis
09
Science | 首次发现促进癌症转移的结构剪切增强子

可变剪接是决定转录组和蛋白质组多样性的关键转录后调控机制。可变剪接模式的病理性变化被认为是癌症的一个重要标志,但潜在的调节机制在很大程度上仍然是未知的。众所周知的是RNA结构元件在可变剪切中发挥着重要作用,但通常用于发现调节元件的生物信息学策略难以获取RNA二级结构对调控的贡献。
2021年5月15日,来自美国加州大学旧金山分校的Hani Goodarzi课题组在science 上发表题为A prometastatic splicing program regulated by SNRPA1 interactions with structured RNA elements 的研究长文,通过pyTEISER技术系统地破译了乳腺癌转移过程中RNA结构元件在病理性可变剪切中的功能,发现了一种全新的结构剪切增强子(SSE),SSE通过与SNRPA1作用促进外显子内含,增强癌细胞的侵袭和转移能力。
更多解读:
为了捕获与乳腺癌转移相关的选择性剪接事件,作者对一种常用的三阴性乳腺癌转移模型细胞MDA-MB-231 (低转移性细胞) 及其肺转移衍生细胞系MDA-LM2(高转移性细胞)进行了RNA测序。然后作者利用pyTEISER (pythonic Tool for Eliciting Informative Structural Elements in RNA),一种基于RNA结构和序列信息来识别顺式调节元件的计算框架,发现了一类在高转移性癌细胞中上调的全新的、高度特异性的RNA结构元件,在可变剪切外显子中的特异富集表明它是一种结构剪接增强子(SSE,structural splicing enhancer)。进一步对临床样本的RNA测序结果也暗示了SSE在可变剪切和癌症发展中的功能。对乳腺癌细胞直接转染含有SSE元件的RNA(与内源SSE竞争),能观察到细胞内源转录本更多地跳过了外显子,证实这些SSE元件可以调控转录本的可变剪切。
SNRPA1 与SSE互作控制可变剪切
通过RNA共沉淀和质谱分析的方法,作者鉴定了跟SSEs相互作用的蛋白,其中SNRPA1(small nuclear ribonucleoprotein polypeptide A′)具有最高的富集倍数。因此作者将本文发现的SSE称为S3E(SNRPA1-associated Structural Splicing Enhancer)。另外,相比于MDA-亲代细胞,高转移性的MDA-LM2细胞中SNRPA1在mRNA和蛋白水平上都显著升高。利用siRNA敲低SNRPA1后,MDA-LM2细胞中含S3E元件的外显子显著降低。反之,过表达SNRPA1会导致MDA-LM2细胞中含S3E元件的外显子显著升高。总之,这些结果表明,SNRPA1促进了高转移癌细胞中含S3E外显子的保留。
为了确定SNRPA1与S3E元件在细胞内存在直接相互作用,作者利用CLIP-seq对MDA-LM2细胞中的SNARPA1进行分析,结果显示SNARPA1的结合位点与S3E元件高度吻合。综上所述,这些数据表明S3Es被SNRPA1结合,通过与SNRPA1直接相互作用,从而调控乳腺癌细胞中转录本的可变剪接。
由于SNRPA1在转移性乳腺癌细胞中控制了可变剪接,作者通过体内转移试验检测了SNRPA1是否影响乳腺癌的进展。结果发现敲低SNRPA1后,癌细胞转移能力显著降低,但SNRPA1的表达水平并不会影响癌细胞的增殖,这些结果表明SNRPA1介导的AS通路可能通过调节病灶粘附活性来影响癌细胞的侵袭、迁移和转移。
SNRPA1调控PLEC和ERRFI1的可变剪接
利用RNA-seq 和SNRPA1 CLIP-seq数据,作者选择了两个与SNRPA1结合且含有S3E元件的基因:PLEC和ERRFI1进行深入研究。通过EMSA证明PLEC和ERRFI1会与SNRPA1选择性结合。通过isoform-specific RT-qPCR, alternative exonflanking RT-PCR等技术验证了SNRPA1在细胞内对两个基因可变剪切的调控。SNRPA1过表达细胞导致可变外显子内含的增加,相反,敲低则会造成可变外显子跳过的增加。通过CRISPR敲除PLEC和ERRFI1中S3E元件后,也会导致可变外显子的跳过,表明S3E元件是SNRPA1调控的可变剪切所必须的。为了评估PLEC可变剪接的功能后果,作者利用反义寡核苷酸诱导外显子跳过,发现PLEC 31号外显子跳过能显著降低癌细胞的转移定植和侵袭能力。这些结果表明SNRPA1能够控制PLEC 31号外显子的可变剪切,PLEC更长的亚型充当癌细胞侵袭和转移的启动子。
SNRPA1表达与乳腺癌进展相关
作者分析了来自乳腺癌患者的公开数据集,并进行了临床相关性研究。与前面的实验结果一致,在多个乳腺癌患者队列中,SNRPA1水平升高与无转移生存期和无复发生存期降低相关。为了进一步验证这些发现,作者对96个来自不同疾病分期的临床样本进行RT-qPCR分析,观察到随着乳腺癌分期的增加,SNRPA1的表达上调。同时在96个临床样本中测量了PLEC 31外显子的内含量,发现晚期乳腺癌中PLEC 包含31外显子的亚型显著升高。最后,作者对组织微阵列进行了免疫分析,结果表明了SNRPA1表达水平与癌症发展之间存在显著关联 。
总结,作者发现了SNRPA1的一个非经典功能:通过与一种全新的RNA结构元件(S3E)相互作用调节可变剪接,增强癌细胞的侵袭和转移能力。S3E结合蛋白SNRPA1充当了乳腺癌转移的启动子的角色,SNRPA1的水平与癌症发展之间存在显著关联。
原文检索:A prometastatic splicing program regulated by SNRPA1 interactions with structured RNA elements
10
Adv Sci | 陶元祥团队发现一个背根节特异性高表达长链非编码RNA可能是调控躯体神经病理性疼痛关键分子

人类基因组转录后能翻译成蛋白的序列仅占2%(即编码RNA),而转录后不能翻译成蛋白的序列约占40%(即非编码RNA)。随着分子生物学研究深入,人们发现除了编码RNA外,非编码RNA也能通过调控基因和/或蛋白表达参与神经系统疾病发生。长链非编码RNA (lncRNA)是近来发现一类长度在200碱基以上非编码RNA,目前已发现数千个lncRNA,它们在神经系统表达丰富,且有高度细胞或组织表达特异性,已证明lncRNA与神经系统多种疾病如脑胶质瘤、阿尔兹海默症、帕金森和慢性疼痛等发生关系密切。因此,研究lncRNA调控疾病机制已迅速成为当前神经生物学家关注的热点。
2021年5月14日,美国罗格斯大学新泽西州立医学院麻醉系陶元祥团队在Advanced Science杂志在线发表题为Downregulation of a dorsal root ganglion-specifically enriched long noncoding RNA is required for neuropathic pain by negatively regulating RALY-triggered Ehmt2 expression 的研究,发现一个背根神经节 (DRG) 特异性高表达lncRNA (DS-lncRNA),可能是调控躯体神经病理性疼痛产生和持续的一个关健分子。
更多解读:
DS-lncRNA首先是从神经损伤背根神经节RNA深度测序中发现,并证实其有两个 6.293-kb和 6.18-kb大小转录异构体。主要表达于DRG中小神经元,且在外周神经损伤后损伤側的DRG中表达显著减少。研究者分别采用病毒载体和转基因小鼠手段,在损伤側的DRG中过表达DS-lncRNA 以阻断神经损伤引起的其减少,小鼠的神经病理疼痛症状均获得显著缓解。相反DRG显微注射其siRNA或者DRG条件性敲除DS-lncRNA下调其在正常小鼠DRG中表达则能诱发产生神经病理痛敏样行为。进一步信息学分析及功能验证试验,发现转录因子Pou4f3是DS-lncRNA表达减少的关键上游调控蛋白。随后通过蛋白质谱鉴定和相关功能验证分析,则发现DS-lncRNA能与转录辅助因子RALY结合。外周神经损伤时因DRG内DS-lncRNA表达减少,结合到RALY蛋白的DS-lncRNA数量亦减少,继而增加了RALY与Ehmt2基因启动子结合数量,同时也增加多聚核糖体II与Ehmt2基因启动子的结合,促进Ehmt2 基因转录及其翻译蛋白G9a表达增加。G9a是组蛋白赖氨酸甲基化转移酶,能通过催化组蛋白H3赖氨酸甲基化降低基因转录效率。以往研究表明,外周神经损伤后,DRG初级感觉神经元中Ehmt2 mRNA/G9a表达增加,参与DRG内约90%以上基因的表达下调,如大多数钾离子通道(Kcna2)和三个阿片受体(Oprm1、Oprd1、Oprk1)等【4,5】。因此G9a被认为是调控神经病理性疼痛的关键分子。DS-lncRNA很可能通过负性调控DRG中Ehmt2及其翻译蛋白G9a表达参与神经病理性疼痛的产生和持续。
该研究揭示了DS-lncRNA通过G9a调控神经病理性疼痛的新机制。由于DS-lncRNA具有在DRG中特异高表达而在其他组织低表达或者不表达的特性,该特性有助于通过选择性上调DRG中DS-lncRNA,继而实现特异性调控DRG中G9a表达达到防治躯体神经病理性疼痛的目的。该研究将为针对外周初级感觉神经元防治神经病理性疼痛的药物开发提供新思路。
原文检索:Downregulation of a dorsal root ganglion-specifically enriched long noncoding RNA is required for neuropathic pain by negatively regulating RALY-triggered Ehmt2 expression
11
Cancer | 免疫治疗新靶点—通过抑制自体吞噬恢复LKB1突变型肺癌中的抗原呈递

LKB1突变型非小细胞肺癌(NSCLC)是肺癌临床治疗中的巨大挑战之一,与其他非小细胞肺癌亚型相比,LKB1突变型非小细胞肺癌的表现特征为肿瘤细胞快速恶性生长,缺乏有效的靶向治疗药物,所以临床上该亚型的总体治疗预后效果很差。尽管PD1抗体在癌症治疗上的应用,彻底改变了其他NSCLC亚型的治疗模式,但目前LKB1突变型肿瘤仍然对这种方法完全无效。2021年5月17日,Kwok-Kin Wong团队(第一作者Jiehui Deng博士)在Nature Cancer上发表了文章ULK1 inhibition overcomes compromised antigen presentation and restores antitumor immunity in LKB1 mutant lung cancer,该研究揭示了LKB1缺失所导致的免疫逃逸机制,并提出了使免疫疗法在这种情况下有效的新方法。论文作者发现,通过靶向抑制ATG1 / ULK1途径,可以抑制细胞自噬,从而恢复肿瘤细胞内免疫蛋白酶体活性和提高肿瘤细胞的抗原呈递。当使用抗ULK1的小分子药物时,LKB1突变型癌细胞通过MHCI上调抗原呈递,引起新抗原特异性效应T细胞的增殖,从而达到抗肿瘤免疫的效应。
更多解读:
LKB1在非小细胞肺癌中经常与KRAS共同突变,KRAS/LKB1(KL)突变的肿瘤对免疫检查点抑制 (immune checkpoint blockade)包括PD1的客观反应率(ORR)低于<10%。与此相对, KRAS / TP53共突变的NSCLC对PD1的客观反应率则高于 30%。KRAS/LKB1和KRAS/TP53 共突变非小细胞肺癌都经常出现在有大量吸烟史的患者中,烟草中的致癌物会导致非同义突变水平的增加,这一特征通常在非小细胞肺癌中对PD1抑制剂更持久的临床反应和更好的生存率呈正相关。这是由于更高水平的非同义突变常常伴随着更高水平的肿瘤新抗原(TMB),当PD1被抑制的情况下可以更好地激活新抗原特异性CD8 + T细胞,达到杀死肿瘤细胞的效应。
该研究发现,当排除吸烟状态对TMB的影响时,从不吸烟的人肺癌患者的LKB1突变肿瘤显示TMB比LKB1野生型高。这与动物模型中LKB1突变肿瘤比Trp53突变肿瘤具有更高的TMB的发现一致。进一步的研究表明,高TMB与对Lkb1突变型肿瘤的抗PD1反应不良之间的脱节是由于LKB1突变抑制了抗原加工和呈递能力。在LKB1突变的非小细胞肿瘤中,免疫蛋白酶体亚基LMP2 / PSMB9的减少和TAP1转运蛋白的下调。最重要的是,KL肿瘤中的免疫蛋白酶体不能加工抗原底物。尽管响应IFNγ刺激,KL肿瘤上的MHCI水平升高,但是向MHCI复合物的抗原肽在细胞表面的呈递却受到了损害。
由于在蛋白质降解过程中的两个主要方式蛋白酶体降解与自噬(autophagy)之间存在平衡关系, LKB1突变肿瘤显示出更高的细胞自噬潮(autophagic flux)和更强的对自噬抑制剂的敏感性。利用这种平衡关系,使用靶向自噬作用的关键调控因子Ulk1的小分子药物MRT68921可以使 Lkb1突变型肿瘤重新敏感于抗PD1阻断作用。这是通过增强免疫蛋白酶体活性来恢复对抗原呈递的抑制,从而通过在LKB1突变肿瘤中CD44 + CD62L-的CD8阳性效应T细胞(CD8+ effector T cells)的增殖,导致T细胞浸润增加以及对抗PD1治疗的反应增强。这项研究证明,通过抑制自噬作用,可以增强肿瘤新抗原呈递,为LKB1突变的高TMB非小细胞肺癌的临床治疗提供了理论基础。
原文检索:ULK1 inhibition overcomes compromised antigen presentation and restores antitumor immunity in LKB1 mutant lung cancer
12
Nat Genet | 路超团队等发现DNA甲基转移酶与组蛋白泛素化修饰间的全新相互作用

DNA甲基化是参与转录调控的重要染色质修饰。在哺乳动物中,DNA甲基化5mC是由DNA甲基转移酶DNMT3A和DNMT3B进行起始(de novo)催化,由DNMT1维持修饰水平,由TET家族酶去除修饰。值得注意的是,DNMT3A的长亚型DNMT3A1是体细胞组织中最主要的起始甲基转移酶。DNMT3A在造血系统恶性癌症中频繁发生突变,同时DNMT3A的生殖系突变也常见于各种人类发育障碍中,提示其在发育和疾病中的重要作用。
近期研究表明,DNMT3A受其PWWP结构域引导,定位到基因组上的组蛋白H3第36位赖氨酸二甲基化(H3K36me2)修饰区域,其次定位到H3K36me3修饰区域。H3K36me2和H3K36me3修饰分别标记基因间区段和基因转录区域,但二者在启动子区的CpG岛上均缺失。与此相应,启动子区的CpG岛也通常不存在DNA甲基化。有趣的是,DNMT3A的PWWP结构域上的突变会导致人和小鼠的生长发育迟缓,同时也会导致多梳蛋白(Polycomb)介导的启动子区CpG岛超甲基化。然而,其中的具体调控机制尚不清楚。
2021年5月13日,美国洛克菲勒大学David Allis研究组、加拿大麦吉尔大学(McGill University)Jacek Majewski研究组以及美国哥伦比亚大学 路超 研究组合作,在Nature Genetics杂志上发表了题为 Two competing mechanisms of DNMT3A recruitment regulate the dynamics of de novo DNA methylation at PRC1-targeted CpG islands的论文,报道了DNMT3A1的N末端区域与多梳抑制复合物1(PRC1)催化的组蛋白H2A第119位赖氨酸泛素化(H2AK119ub)修饰之间的一种新的相互作用。这种相互作用与该团队之前报道的PWWP-H3K36me2间的相互作用在招募DNMT3A上处于竞争关系。
更多解读:
在这项研究中,研究者检查了携带PWWP结构域缺失或突变的DNMT3A在基因组上的分布,发现其从H3K36me2修饰富集区域重新定位到了多梳蛋白调控的CpG岛上。此外,研究者还发现携带PWWP突变的DNMT3A与H2AK119ub修饰的共定位水平强于PRC2催化的H3K27me3修饰。结果证明,敲除PRC1(Ring1a/b),而非PRC2(Ezh2),能够破坏携带PWWP突变的DNMT3A与CpG岛的结合。
该研究通过对全长DNMT3A1和一组经过化学修饰的核小体之间进行体外结合实验,证明DNMT3A1与H2AK119ub修饰的核小体间存在强烈且特异性的结合能力,其与H3K27me3修饰的核小体间则不存在。重要的是,研究者发现将DNMT3A的短亚型DNMT3A2或DNMT3B中的PWWP结构域删除,均不会使它们重新定位到多梳蛋白介导的CpG岛上。与DNMT3A2相比,长亚型DNMT3A1有一个额外的N末端结构域,但功能不详。研究者将DNMT3A1的N端结构域替换给删除了PWWP结构域的DNMT3B上,结果其获得了重新定位到H2AK119ub修饰区域的能力,这表明DNMT3A1和H2AK119ub修饰的相互作用是通过其N末端区域介导的。最后,研究者通过在携带PWWP结构域突变DNMT3A的细胞中敲除Ring1a/b,逆转了CpG岛DNA甲基化水平的异常上升,进一步证明了DNMT3A通过与PRC1催化的H2AK119ub修饰相互作用,最终导致CpG岛超甲基化。
综合上述,这项研究揭示了启动子CpG岛的起始甲基化的潜在调控机制,而这种甲基化在正常发育或癌症发展过程中均有发生。未来在结构-功能方面进一步分析DNMT3A1与H2AK119ub修饰间的相互作用,将使我们能够从病理生理学角度更好地理解和靶向DNA的起始甲基化修饰过程。
原文检索:Two competing mechanisms of DNMT3A recruitment regulate the dynamics of de novo DNA methylation at PRC1-targeted CpG islands
其他最新文章推荐
The AIM2 and NLRP3 inflammasomes trigger IL-1–mediated antitumor effects during radiation

YAP promotes the activation of NLRP3 inflammasome via blocking K27-linked polyubiquitination of NLRP3

Mitochondrial TNAP controls thermogenesis by hydrolysis of phosphocreatine

Pathogenic variants in SMARCA5, a chromatin remodeler, cause a range of syndromic neurodevelopmental features

FUT8-mediated aberrant N-glycosylation of B7H3 suppresses the immune response in triple-negative breast cancer

The SAM domain-containing protein 1 (SAMD1) acts as a repressive chromatin regulator at unmethylated CpG islands

资料整理:西湖生物医药综合办公室
文章来源:公开信息搜集
